2 广东省深圳市宝安区人民医院急诊科 518101;
3 广东省普宁市人民医院消化内科 515300;
4 广东省普宁市下架山镇下架山卫生院急诊科 515300
2 Emergency Department, Bao'an People's Hospital, Shenzhen 518101, China;
3 Gastroenterology Department, Puning People's Hospital, Puning 515300, China;
4 Emergency Department, Puning Xiajiashan's Health Center, Puning 515300, China
急性呼吸窘迫综合征(acute respiratory distress syndrome, ARDS)是由心源性因素以外的各种致病因素引起的持续性低氧血症为显著特征的临床综合征。ARDS发病率约在59~79/10万,当患者存在严重感染时ARDS患病率高达35%~46% [1],院内病死率高达40% [2],ARDS的救治已经成为区域内重大公共卫生难题。在临床治疗上,虽然小潮气量等肺通气保护性通气策略[3]、激素[4]、体外膜肺[5]及俯卧位通气[3]等均已得到临床证据支持,但以上治疗仍以支持治疗为主,缺乏特异性方法,因此病死率并无明显降低[2]。尤其缺乏针对ARDS高危因素以及其炎症反应的干预措施[6-7],因此只有早期诊断ARDS的发生,尽早干预其进展,才是逆转病情的关键。有研究表明,生物标志物检测能提升ARDS的早期诊断,近年来组合检测生物标志物用于ARDS的早期诊断是研究热点之一。已有研究证实,在ARDS早期,组合检测生物标志物结果优于单独检测[8-9]。本研究回顾性分析深圳宝安区人民医院200例危重患者临床资料,发现组合检测血清Ang-2与CC16水平有利于早期诊断ARDS,并发现组合检测敏感性优于单项检测,现报道如下。
1 资料与方法 1.1 一般资料本研究选取2015年3月至2016年9月期间收入深圳市宝安区人民医院重症监护病房的危重病患者,经家属同意后纳入研究。本课题已经获得深圳市宝安区人民医院伦理委员会的批准。
1.1.1 纳入标准① 脓毒症/脓毒性休克;②全身性多发伤;③吸入性肺炎、社区获得性肺炎或重症肺炎;④危重手术术后;⑤入科前曾发生持续性低氧血症或需要呼吸支持;⑥发病过程小于一周;⑦药物中毒引起的急性肝功能衰竭或急性肾功能衰竭;⑧心肺复苏术后。
1.1.2 排除标准① 危重孕产妇;②在重症医学科存活时间 < 12 h;③各种原因引起的恶病质或长期营养不良;④年龄 > 85岁或 < 16岁。
1.1.3 ARDS诊断标准参照柏林标准:①一周内的急性起病或慢性呼吸疾病急性加重的呼吸症状;②出现低氧血症, 根据氧合指数(PaO2/FiO2)分为轻度、中度、重度,轻度为氧合指数在200~300 mmHg (1 mmHg=0.133 kPa)且呼吸末正压≥5 cmH2O (1 cmH2O=0.098 kPa);中度为氧合指数在100~200 mmHg且呼吸末正压≥5 cmH2O;重度为氧合指数小于100 mmHg且呼吸末正压≥5 cmH2O;③肺水肿的病因, 各种除心源性因素以外的疾病引起的肺水肿;④床边胸片提示双肺弥漫性斑片状模糊影且无法用肺结节、肺部胸腔积液或肺不张完全解释。
1.1.4 排除ARDS标准① 明确患者存在心功能不全或者检查提示存在胸腔积液或者心源性肺水肿;②单纯既往的慢性肺部疾病,如COPD、哮喘、肺结核;③血氧饱和度良好,无需无创或有创呼吸支持;④肺部影像学检查未发现两肺弥漫性斑片状模糊影或者存在胸腔积液;⑤PaO2/FiO2 > 300 mmHg。
所有患者病历资料最终由两名主治以上技术职称医师在48 h内根据柏林标准分析患者各项指标是否符合ARDS诊断标准。
1.2 标本采集与方法记录患者入科时的氧分压、给氧体积分数并计算出相应的氧合指数,完善各患者的病史采集及临床的各项生化指标(心电监护结果、生命体征变化、首日与次日血清Ang-2与CC16水平等),并完成入科首日的APACHE Ⅱ评分。
1.3 统计学方法计量资料以均数±标准差(Mean±SD)表示,两组间资料比较采用成组t检验等进行检验。运用多重受试者工作特征曲线(多重ROC)分析定量指标,得出相应的敏感度、特异度、曲线下面积(AUC)和判断临界值,所有统计分析均采用SPSS 19.0和Medcalc、GraphPad Prism进行及绘制图像。以P < 0.05为差异有统计学意义。
2 结果 2.1 纳入危重患者的基本情况整个研究入组病例共200例。ARDS患者100例,其患者原发病因类型分布为:重症肺炎50例、感染性休克/感染性疾病18例、慢性阻塞性肺疾病急性发作3例、急性重症胆管炎5例、急性重症胰腺炎5例、急性或慢性肾衰竭6例、心源性休克7例、其他疾病6例;非ARDS患者100例,其患者原发病因类型分布为:感染性休克/感染性疾病22例、失血性休克12例、心源性休克9例、急性重症胰腺炎8例、急性/慢性肾衰竭6例、急性脑出血21例、脑梗死9例、肿瘤6例、其他疾病7例。观察入科时ARDS组与非ARDS两组各项指标对比,发现组间除氧合指数外,其余各项指标差异无统计学意义,因此组间资料基本一致,具有可比性,见表 1。
| 指标 | ARDS组(n=100) | 非ARDS组(n=100) | t值 | P值 |
| 性别(男/女,例) | 59/41 | 63/37 | -0.577 | 0.564 |
| 年龄(岁) | 57±20 | 46±17 | -4.058 | 0.972 |
| 体温(℃) | 36.87±0.99 | 36.89±0.93 | 0.205 | 0.838 |
| 入科收缩压(mmHg) | 126.48±28.73 | 132.99±29.76 | 1.574 | 0.177 |
| 入科舒张压(mmHg) | 79.75±20.23 | 82.28±19.79 | 0.894 | 0.372 |
| 白细胞(×109/L) | 12.63±7.96 | 15.23±7.77 | -0.247 | 0.472 |
| 血小板(×1012/L) | 202.86±114.55 | 167.31±97.65 | -1.684 | 0.646 |
| 肌酐(μmol/L) | 165.99±172.47 | 138.92±256.03 | -0.862 | 0.310 |
| D-二聚体(mg/L) | 4 700.96±8 753.85 | 5 752.69±18 684.33 | -0.478 | 0.563 |
| 总蛋白(g/L) | 56.71±11.47 | 58.18±13.84 | 0.811 | 0.419 |
| 白蛋白(g/L) | 30.33±21.85 | 31.74±8.35 | 0.603 | 0.546 |
| 氧合指数(mmHg) | 164.73±56.17 | 448.55±105.51 | 23.745 | 0.001 |
| APACHEⅡ评分 | 20.09±6.97 | 17.71±5.39 | 0.144 | 0.104 |
入科首日及次日,ARDS组的血清Ang-2水平(pg/mL)高于非ARDS组(5 739.38±3 215.77 vs 3 908.81±3 291.01和5 505.07±2 955.59 vs 4 209.39±3 484.98,P < 0.05);ARDS组血清CC16水平(ng/mL)高于非ARDS组(54.90±28.80 vs 29.32±18.63和45.80±28.34 vs 31.56±22.35,P < 0.05);首日与次日血清Ang-2之差两组差异无统计学意义;首日与次日血清CC16之差两组差异有统计学意义,见表 2。说明血清Ang-2下降速度较慢,在血液中可一段时间持续高水平,而血清CC16下降速度较快。
| 指标 | ARDS组(n=100) | 非ARDS组(n=100) | t值 | P值 |
| 首日血清Ang-2水平(pg/mL) | 5 739.38±3 215.77 | 3 908.81±3 291.01 | -3.938 | < 0.01 |
| 次日血清Ang-2水平(pg/mL) | 5 505.07±2 955.59 | 4 209.39±3 484.98 | -2.707 | 0.007 |
| 首日与次日血清Ang-2之差(pg/mL) | 120.11±1 823.55 | 277.78±2 490.91 | -1.289 | 0.199 |
| 首日血清Cc16水平(ng/mL) | 54.90±28.80 | 29.32±18.63 | -7.457 | < 0.01 |
| 次日血清Cc16水平(ng/mL) | 45.80±28.34 | 31.56±22.35 | -3.690 | < 0.01 |
| 首日与次日血清Cc16之差(ng/mL) | 5.12±14.75 | 1.87±17.53 | -3.137 | 0.002 |
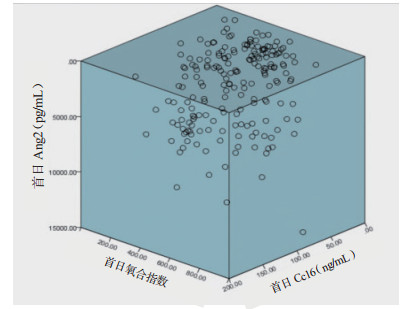
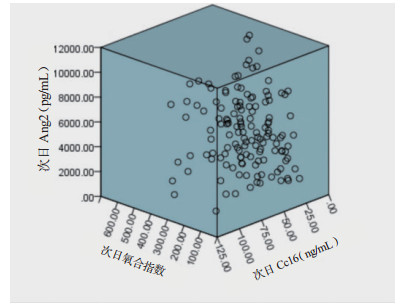
采用Pearson相关分析ARDS患者的血清Ang-2、CC16水平和氧合指数之间两两的相关性,并对其采用两变量,将入科时的数值进行分析,见图 1~2,显示ARDS患者氧合指数与血清Ang-2和CC16之间无相关关系,但血清Ang-2水平与血清CC16水平存在相关关系。
|
| 图 1 ARDS患者首日Ang-2、CC16和氧合指数间两两的关系(n=100) Fig 1 The correlation between Ang-2, CC16 and oxygenation index in the first day in ARDS patients (n=100) |
|
|
|
| 图 2 ARDS患者次日Ang-2、CC16和氧合指数间两两的关系(n=100) Fig 2 The correlation between Ang-2, CC16 and oxygenation index in the second day in ARDS patients (n=100) |
|
|
根据线性回归方程分析ARDS患者首日血清Ang-2和CC16水平及次日血清Ang-2和CC16水平,结果提示ARDS患者首日血清Ang-2和CC16水平存在线性关系,回归方程为Y=4 496.338+22.641X;ARDS患者次日血清Ang-2和CC16水平也存在线性关系,回归方程为Y=3 920.435+31.811X。
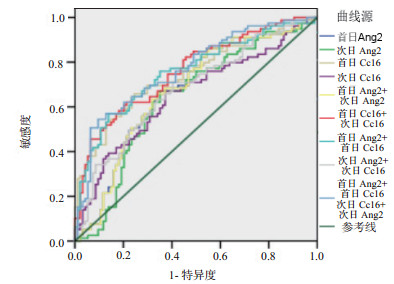
2.5 血清Ang-2和CC16水平对ARDS的诊断阈值采用受试者工作特征(ROC)曲线对各指标进行分析,首日及次日血清Ang-2和CC16水平对ARDS有诊断意义。如表 3和图 3所示,首日及次日血清Ang-2水平参考指标的曲线下面积具有统计学意义,相应对重症患者发生ARDS的诊断阈值分别为首日血清Ang-2 > 4 275.01 pg/mL,敏感度为65.8%,特异度为66.0%;次日血清Ang-2 > 3 935.12 pg/mL,敏感度为67.1%,特异度为64.9%。CC16水平参考指标的曲线下面积具有统计学意义,其相应对重症患者发生ARDS的诊断阈值分别为首日血清CC16 > 33.67 ng/mL,敏感度为69.6%,特异度为70.2%;次日血清CC16 > 27.59 ng/mL,敏感度为67.1%,特异度为62.8%。两项组合检测对早期诊断ARDS的敏感性有所增加;其中敏感性最高为首日Ang-2组合首日CC16(敏感度为75.9%),特异性最高为首日血清CC16水平(特异度为70.2%)。
| 变量 | AUC | S.E. | 95%CI | 阈值 | 敏感度(%) | 特异度(%) |
| 首日血清Ang-2水平 | 0.671 | 0.041 | 0.590~0.753 | > 4 275.01 pg/mL | 65.8 | 66.0 |
| 次日血清Ang-2水平 | 0.636 | 0.043 | 0.552~0.720 | > 3 935.12 pg/mL | 67.1 | 64.9 |
| 首日血清Cc16水平 | 0.743 | 0.038 | 0.669~0.818 | > 33.67 ng/mL | 69.6 | 70.2 |
| 次日血清Cc16水平 | 0.651 | 0.042 | 0.568~0.734 | > 27.59 ng/mL | 67.1 | 62.8 |
| 首日Ang-2+次日Ang-2 | 0.671 | 0.041 | 0.590~0.753 | 68.4 | 62.8 | |
| 首日Cc16+次日Cc16 | 0.760 | 0.036 | 0.552~0.720 | 74.7 | 61.7 | |
| 首日Ang2+首日Cc16 | 0.756 | 0.037 | 0.669~0.818 | 75.9 | 64.9 | |
| 次日Ang2+次日Cc16 | 0.676 | 0.041 | 0.568~0.734 | 70.9 | 59.6 |
|
| 图 3 组合血清Ang-2和CC16水平指标对重症患者发生ARDS的ROC曲线 Fig 3 The ROC analysis of Ang-2 and CC16 on diagnosis of ARDS in critical care patients |
|
|
目前ARDS的诊断是采用2011年的柏林诊断标准。这种基于临床指标的诊断方法有其缺陷,即患者符合ARDS诊断标准时,机体已出现严重的失代偿状态,本课题组前期研究发现Berlin诊断标准根据氧合指数分轻、中、重度3个等级虽然有助于早期识别和预警,但3组患者早期临床特征相似,却有部分轻、中度患者仍恶化至需有创机械通气[10]。若此类患者早期无创通气失败,患者会在(7.8±2.4)h内需有创通气,且早、晚期病死率可高达47.6%及61.9%[11]。这也是ARDS特异性治疗方案不多且病死率改善不明显的主要因素。在ARDS诊断上存在最大的问题是诊断方法滞后于病理生理机制,因为ARDS是在感染、烧伤、休克及创伤等非心源性因素诱发急性弥漫性肺部炎症反应,临床诊断标准主要依据氧合指数,但是由于肺具有巨大呼吸代偿能力,PaO2在ARDS初期降低并不明显,后期严重下降时已无强力有效的干预措施。基于ARDS的病理生理复杂且过程中产生了许多与ARDS相关的生物标志物,因此寻找特异性强、敏感性高的生物标志物不仅是提高ARDS的早期诊断率的关键,也为ARDS的治疗提供新的思路。
本课题组前期对涎液化糖链抗原(KL-6)、肝细胞生长因子(HGF)、细胞间黏附分子-1(ICAM-1)、Ang-2、蛋白C(PC)、纤溶酶原激活物抑制剂-1(PAI-1)、血栓调节蛋白(TM)、血管内皮生长因子(VEGF)、晚期糖基化终末产物受体(RAGE)、HMGB1、CC16等20余项ARDS生物标志物分析后认为,单项标志物可应用于ARDS诊断与分级,在评估ARDS高风险人群、临床疗效、疾病预后,甚至临床试验项目优化方面起到一定作用[12]。临床研究已发现血清CC16能够早期诊断ARDS的发生,其最佳临界值是33.3 ng/L,并且可作为ARDS分级的参考指标[13]。所以生物标志物在ARDS的早期诊断、分级及预后判断具有较大的研究价值,但单项检测仍缺乏高准确性及高可靠性,因此近年来临床上组合检测生物标志物用于ARDS的早期诊断是热点之一。已有研究均证实联合检测生物标志物优于单项检测,但组合检测项目越多,费用越昂贵,选择哪些生物标志物组合检测、避免变化规律或意义相同的生物标志物进入同一组合检测是临床上面临的难题。
本研究在以往的研究基础上,联合检测CC16及Ang-2用于危重病患者早期诊断ARDS的发生,结果证实血清Ang-2和CC16单项检测均对ARDS具有早期诊断价值,而且组合两项检测后其敏感性优于单项检测。其中Ang-2的相关ARDS研究有Zinter等[14]对259例ARDS患儿的研究和黄莹等[15]对32例ARDS患者与251例非ARDS患者的研究,均已证实ARDS患者血清Ang-2水平显著高于非ARDS患者,且血清Ang-2水平在ARDS死亡组明显高于ARDS存活组,可见Ang-2不仅仅可用于诊断ARDS,其持续维持高水平能够提示患者预后不良。结合本研究结果,首日与次日血清Ang-2之差下降不明显,可见Ang-2一旦激活后将持续维持高水平,Ang-2具有强大的促炎效应,在炎症进程里,过度释放的Ang-2可提升血管通透性,导致血管内液体渗出,其原理是刺激前列腺素和血管内皮细胞生长因子的分泌,也可上调黏附分子如选择蛋白、细胞间1型黏附分子以及激活的单核细胞来启动炎症;除此之外Ang-2也可上调Ⅰ型单核细胞趋化蛋白(MCP-1)、肿瘤坏死因子(TNF)-α、白介素-6(IL-6)等炎症诱导蛋白,激活中性粒细胞。Ang-2通过血管紧张素Ⅱ1型受体(AT1R)诱导蛋白质活性氧簇(ROS)来产生巨噬细胞和激活核因子κB(NF-κB),可以激活急性炎症标志物C反应蛋白(CRP)明显上调,随即CRP可进入血管平滑肌等细胞内上调AT1R mRNA和增加AT1R编码的表达,进而形成正反馈,从而放大炎症反应。以上所有途径最终诱发炎症反应,导致器官及线粒体损伤。因此Ang-2不仅仅可作为生物标志物,其持续升高提示炎症反应持续存在,患者预后不良。
本研究还发现血清Ang-2和CC16水平之间呈线性关系。考虑原因之一可能是上游因子的同源性,可同时激活Ang-2和CC16;也可能由于Ang-2被激活后导致下游的β1整联蛋白正向拉长基质黏连增强和内皮细胞间的连接降低,使得血管内皮细胞的稳定性受到破坏,从而释放肺泡上皮的CC16入血,但其具体机制仍需进一步探讨。两组患者首日与次日血清CC16之差差异有统计学意义,说明血清CC16经治疗后,下降速度快且独立性强,对早期诊断ARDS具有较强的特异性。
综上所述,单项检测血清Ang-2与CC16水平均可用于早期诊断ARDS,且组合两项后其敏感性优于单项检测。故临床上适当选择组合检测有利于早期诊断ARDS,以便尽早采用针对性治疗。
| [1] | Gilbert JA. Advancing towards precision medicine in ARDS[J]. Lancet Respir Med, 2018, 6(7): 494-495. DOI:10.1016/s2213-2600(18)30156-5 |
| [2] | Bellani G, Laffey JG, Pham T, et al. Epidemiology, patterns of care, and mortality for patients with acute respiratory distress syndrome in intensive care units in 50 countries[J]. JAMA, 2016, 315(8): 788. DOI:10.1001/jama.2016.0291 |
| [3] | Modrykamien AM, Daoud Y. Factors among patients receiving prone positioning for the acute respiratory distress syndrome found useful for predicting mortality in the intensive care unit[J]. Bayl Univ Med Cent Proc, 2018, 31(1): 1-5. DOI:10.1080/08998280.2017.1391560 |
| [4] | Kinoshita Y, Ishii H, Kushima H, et al. High-dose steroid therapy for acute respiratory distress syndrome lacking common risk factors: predictors of outcome[J]. Acute Med Surg, 2018, 5(2): 146-153. DOI:10.1002/ams2.321 |
| [5] | Bein T, Aubron C, Papazian L. Focus on ECMO and ECCO2R in ARDS patients[J]. Intensive Care Med, 2017, 43(9): 1424-1426. DOI:10.1007/s00134-017-4882-1 |
| [6] | Lee H, Abston E, Zhang D, et al. Extracellular vesicle: an emerging mediator of intercellular crosstalk in lung inflammation and injury[J]. Front Immunol, 2018, 9: 924. DOI:10.3389/fimmu.2018.00924 |
| [7] | Fan EKY, Fan J. Regulation of alveolar macrophage death in acute lung inflammation[J]. Respir Res, 2018, 19(1): 50. DOI:10.1186/s12931-018-0756-5 |
| [8] | Maile MD, Standiford TJ, Engoren MC, et al. Associations of the plasma lipidome with mortality in the acute respiratory distress syndrome: a longitudinal cohort study[J]. Respir Res, 2018, 19(1): 60. DOI:10.1186/s12931-018-0758-3 |
| [9] | Ware LB, Zhao ZG, Koyama T, et al. Derivation and validation of a two-biomarker panel for diagnosis of ARDS in patients with severe traumatic injuries[J]. Trauma Surg Acute Care Open, 2017, 2(1): e000121. DOI:10.1136/tsaco-2017-000121 |
| [10] | 王黎, 林锦乐, 田方, 等. 柏林标准对96例急性呼吸窘迫综合征患者的预后判断价值[J]. 临床急诊杂志, 2015, 16(6): 421-424, 427. DOI:10.13201/j.issn.1009-5918.2015.06.006 |
| [11] | 李丽萍, 林锦乐, 张文武, 等. 急性呼吸窘迫综合征无创通气模式失败信号分析[J]. 临床急诊杂志, 2015, 16(8): 621-624. DOI:10.13201/j.issn.1009-5918.2015.08.015 |
| [12] | 傅萱, 林锦乐, 张文武, 等. ARDS生物标志物的研究进展[J]. 中华危重病急救医学, 2017, 29(7): 656-661. DOI:10.3760/cma.j.issn.2095-4352.2017.07.018 |
| [13] | Lin JL, Zhang WW, Wang LJ, et al. Diagnostic and prognostic values of Club cell protein 16 (CC16) in critical care patients with acute respiratory distress syndrome[J]. J Clin Lab Anal, 2018, 32(2): e22262. DOI:10.1002/jcla.22262 |
| [14] | Zinter MS, Spicer A, Orwoll BO, et al. Plasma angiopoietin-2 outperforms other markers of endothelial injury in prognosticating pediatric ARDS mortality[J]. Am J Physiol Cell Mol Physiol, 2016, 310(3): L224-231. DOI:10.1152/ajplung.00336.2015 |
| [15] | 黄莹, 彭再梅. 血管生成素2在评估急性呼吸窘迫综合征中的临床价值[J]. 中华急诊医学杂志, 2014, 23(10): 1151-1154. DOI:10.3760/cma.j.issn.1671-0282.2014.10.020 |
 2019, Vol. 28
2019, Vol. 28




