2 陕西省第四人民医院心内科,西安 710043
患者女性,48岁,因“发作性胸痛12 h”急诊入院,患者无明显诱因突发心前区疼痛,伴胸闷气促、大汗,持续十余分钟后自行缓解,缓解时隐痛,发作与活动等无关。既往高血压病史3年余,未规律用药及监测血压,无糖尿病史,无烟酒嗜好。入院查体:Bp 165/90 mmHg(1 mmHg=0.133 kPa),神志清楚,甲状腺无肿大及压痛,质地中等,未及血管杂音。双肺呼吸音粗,未及干湿性啰音。心率102次/min,律齐,心音正常,各瓣膜听诊区未及明显杂音,双下肢无水肿。发作时心电图示:1.窦性心动过速(110次/min); 2.电轴左偏; 3.aVR导联ST段抬高伴广泛导联ST段压低超过1.0 mV。辅助检查:NT-ProBNP 4 426 pg/mL(标准值> 900 pg/mL),心梗三项:TnI 5.6 ng/mL(0~0.5 ng/mL),CK-MB 41 ng/mL(0~5.0 ng/mL),Myo 282.9 ng/mL(0~80 ng/mL); 入院予抗血小板聚集、抗凝、调脂稳定斑块、扩冠等治疗,次日复查心梗三项:TnI > 30 ng/mL,CK-MB 81.8 ng/mL,Myo 39.7 ng/mL; 床边心脏超声示LVEF 35%(标准值50%~80%),节段性室壁运动异常,心功能不全; 入院后患者仍反复发作性胸痛,胸痛缓解时心电图示ST段水平型压低(图 1~2),提示冠状动脉左主干病变。行冠状动脉造影检查示正常冠脉(图 3)。考虑胸痛为冠脉左主干痉挛所致,加用地尔硫卓90 mg/d,查甲状腺功能提示游离甲状腺三碘原氨酸(FT3)20.17 pmol/L(3.1~6.8 pmol/L),游离甲状腺(FT4)65.46 pmol/L(12~22 pmol/L),促甲状腺激素(TSH) < 0.005 mU/L(0.27~4.2 mU/L),考虑甲状腺功能亢进症,加用丙硫氧嘧啶100 mg/8 h、利可君片20 mg/8 h,患者胸痛症状明显缓解,出院随访一年余,患者甲状腺功能恢复正常,未再有胸痛发作。
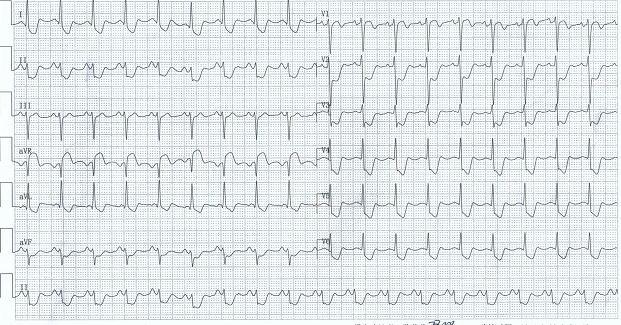
|
| 图 1 患者胸痛发作时心电图(示Ⅰ、avL、Ⅱ、Ⅲ、aVF导联和V4~V6导联广泛ST段压低超过1.0 mV,且aVR导联ST段抬高,幅度大于V1导联) |
|
|
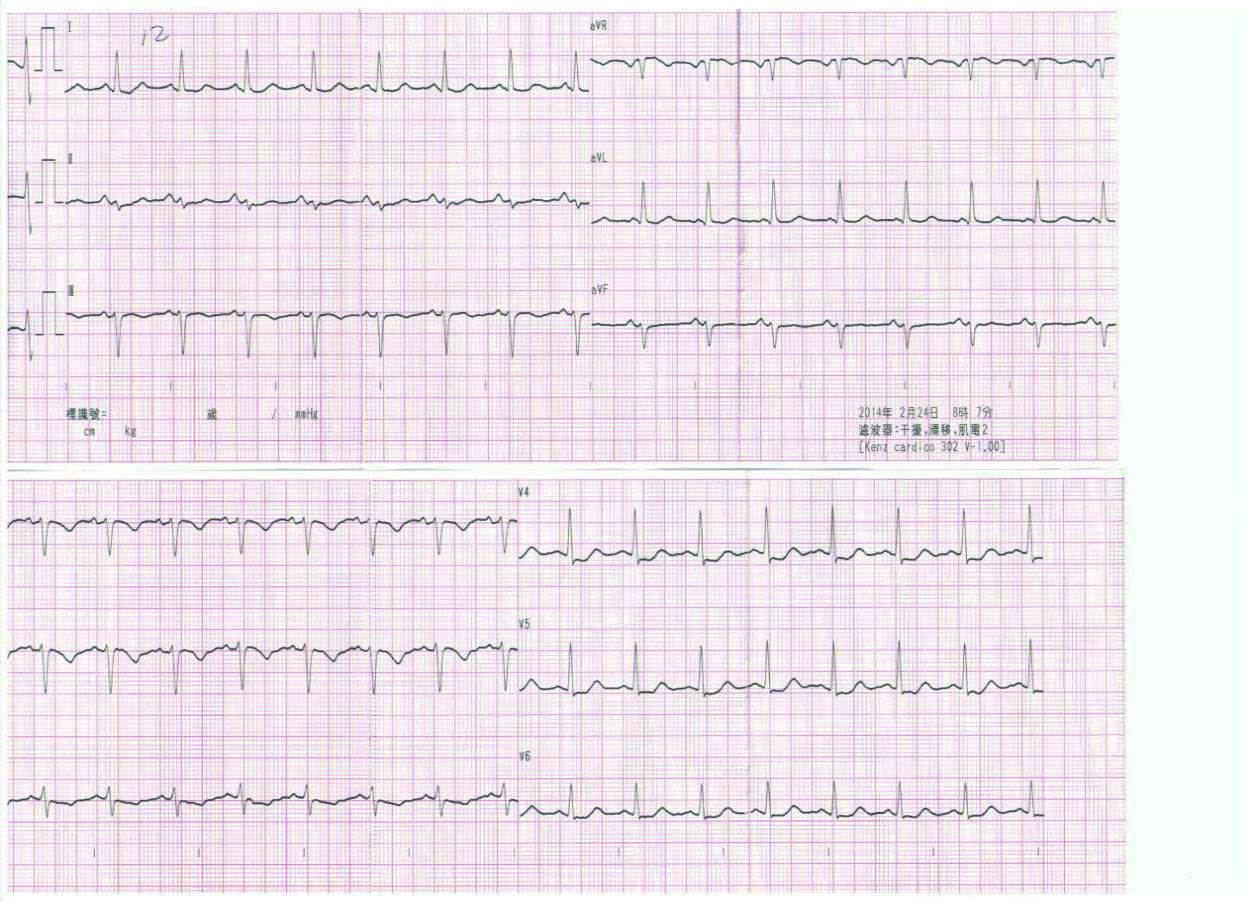
|
| 图 2 患者胸痛缓解时心电图(示V4~V6 ST段水平型压低) |
|
|
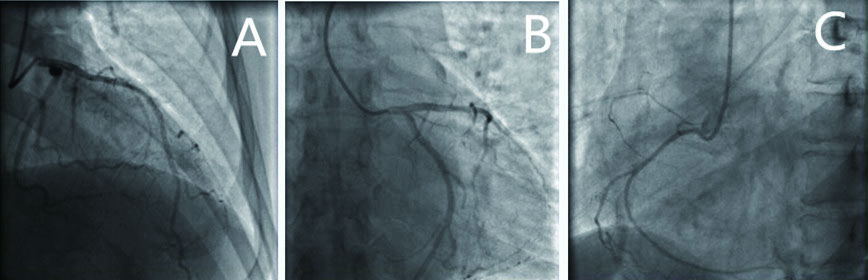
|
| 图 3 患者冠脉造影结果(示左主干未见狭窄,A为前降支、B为回旋支、C为右冠冠脉光滑,远端血流TIMI3级) |
|
|
本例患者为中年女性,有高血压病史,无高血脂、糖尿病、吸烟等危险因素,平素虽无心慌、怕热出汗、进食增多、体质量减少、易激动现象,甲状腺功能示FT3、FT4明显升高,TSH明显降低,甲状腺功能亢进症(甲亢)诊断明确。患者反复发作性胸痛,与劳力无关,发作时呈典型左主干病变心电图改变,心肌损伤标志物明显升高并有动态变化,超声心动图发现节段性室壁运动障碍伴心功能下降,冠状动脉造影结果正常,甲亢合并冠状动脉左主干痉挛(coronary artery spasm,CAS)致急性心肌梗死诊断明确。
CAS是各种原因所致的心外膜冠状动脉异常收缩,其引起的短暂性心肌缺血可并发心肌梗死、不稳定性心绞痛、心力衰竭和恶性心律失常,甚至导致猝死[1]。冠状动脉内皮功能受到干扰、迷走神经张力抑制、活性氧簇和(或)NO生物活性降低等均易诱发CAS,尤其吸烟、绝经后女性、午夜或清晨之间心绞痛表现均应优先考虑痉挛性心绞痛。临床上心电图一般表现为ST段抬高及压低、峰值延迟和R波高度和宽度增加,S波的幅度减小等[2]。
甲亢的心脏表现主要有心绞痛、心房颤动、心力衰竭、心源性休克等,而CAS较为少见[3]。相关研究表明甲亢通过调节每搏输出量、心率、心肌收缩影响心血管系统。甲状腺激素增加外周氧耗及底物需求,增加心脏收缩力; 扩张微动脉降低全身血管阻力,增加全身血容量,从而增加心率及心输出量。甲亢患者全身处于高代谢状态,氧耗及血供失衡可致心肌缺血缺氧而诱发痉挛; 参与调节血管平滑肌细胞肌质网钙腺苷三磷酸酶、钙激活的ATP酶、受磷蛋白的产生及多种质膜离子转运体如Na+/K+-ATPase、Na+/Ca2+交换体和电压门控钾通道等, 从而协调心肌细胞电化学和机械反应,甲亢引起甲状腺激素过量从而诱发CAS[4]。
其次,甲亢可通过调节平滑肌张力和内皮功能影响心血管系统。已有报道甲亢患者继发于内皮细胞NO产生和儿茶酚胺介导的内皮组分敏感性增加,增强去甲肾上腺素及5-羟色胺对血管收缩反应的敏感性诱发CAS[5-6]。Carrillo-Sepalveda等[7]实验证明T3通过PI3K/Akt途径导致血管平滑肌细胞中NO产生增加及通过AT2R/Akt/NO通路降低T3促进的大鼠主动脉收缩反应,加重血管反应性造成CAS。
最后,甲亢也可通过脂质代谢和调节炎症通路直接影响心血管系统[8]。Hoshino等[9]证明慢性氧化应激、巯基氧化和ρ激酶信号与CAS相关; Venditti等[10]报道甲亢患者体内活性氮及活性氧含量升高、脂质过氧化反应增加,促进血管内皮障碍的发生; 活性氧引起血管紧张素转换酶增加,加重血管痉挛。另外,甲亢患者血管内皮分泌的炎性黏附因子如细胞间黏附分子1、血管细胞黏附分子1等水平升高,促进白细胞在损伤的内皮区域积聚,导致血管痉挛[11]。Kim等[12]发现一旦患者甲状腺功能恢复正常,临床过程就会变得稳定,预后良好。
临床上,左主干病变患者的预后差、疾病病死率高,因而对于左主干闭塞的急性冠脉综合征患者,及时早期诊断十分重要。急诊发现特征性“6+2现象”心电图时应考虑左主干病变可能,如单纯抗痉挛治疗效果不好时要排除甲亢合并冠状动脉痉挛情况,及时给予甲亢的相应治疗。
| [1] | Lin Y, Qin H, Chen R, et al. A comprehensive clinical diagnostic score system for prediction of coronary artery spasm in patients with acute chest pain[J]. IJC Heart Vasc, 2019, 23(22): 205-209. DOI:10.1016/j.ijcha.2019.02.001 |
| [2] | Hung M, Hu P, Hung M. Coronary artery spasm:review and update[J]. Int J Med Sci, 2014, 11(11): 1161-1171. DOI:10.7150/ijms.9623 |
| [3] | Al JJ, Haque S, Noor H, et al. Thyrotoxicosis and coronary artery spasm: case report and review of the literature[J]. Angiology, 2010, 61(8): 807-812. DOI:10.1177/0003319710365146 |
| [4] | Razvi S, Jabbar A, Pingitore A, et al. Thyroid hormones and cardiovascular function and diseases[J]. J Am Coll Cardiol, 2018, 71(16): 1781-1796. DOI:10.1016/j.jacc.2018.02.045 |
| [5] | Choi YH, Chung JH, Bae SW, et al. Severe coronary artery spasm can be associated with hyperthyroidism[J]. Coron Artery Dis, 2005, 16(3): 135-139. DOI:10.1097/00019501-200505000-00001 |
| [6] | Wang D, Hu H, Qiang F, et al. Left main coronary artery spasm in a hyperthyroid patient with suspected acute coronary syndrome[J]. Pak J Med Sci, 2013, 29(5): 1285-1287. |
| [7] | Carrillo-Sepalveda MA, Ceravolo GS, Furstenau CR, et al. Emerging role of angiotensin type 2 receptor (AT2R)/Akt/NO pathway in vascular smooth muscle cell in the hyperthyroidism[J]. PLoS One, 2013, 8(4): e61982. DOI:10.1371/journal.pone.0061982 |
| [8] | Pramfalk C, Pedrelli M, Parini P. Role of thyroid receptor β in lipid metabolism[J]. Biochim Biophys Acta, 2011, 1812(8): 929-937. DOI:10.1016/j.bbadis.2010.12.019 |
| [9] | Hoshino Y, Yamada S, Saitoh S, et al. Age-related oxidant stress with senescence marker protein-30 deficiency plays a pivotal role in coronary artery spasm[J]. Coron Artery Dis, 2013, 24(2): 110-118. DOI:10.1097/MCA.0b013e32835c8f96 |
| [10] | Venditti P, Di SL, Di MS. Vitamin E management of oxidative damage-linked dysfunctions of hyperthyroid tissues[J]. Cell Mo Life Sci, 2013, 70(17): 3125-3144. DOI:10.1007/s00018-012-1217-9 |
| [11] | Jublanc C, Beaudeux JL, Aubart F, et al. Serum levels of adhesion molecules ICAM-1 and VCAM-1 and tissue inhibitor of metalloproteinases, TIMP-1, are elevated in patients with autoimmune thyroid disorders: relevance to vascular inflammation[J]. Nutr Metab Cardiovasc Dis, 2011, 21(10): 817-822. DOI:10.1016/j.numecd.2010.02.023 |
| [12] | Kim K, Mow C, Khet F. A combination of tachycardia-mediated heart failure and coronary artery vasospasm-induced silent myocardial infarction in a patient with severe thyrotoxicosis[J]. Case Rep Cardiol, 2018, 2018: 1-5. DOI:10.1155/2018/4827907 |
 2019, Vol. 28
2019, Vol. 28




