脓毒症(sepsis)是机体对感染反应失调而导致的危及生命的器官功能障碍[1]。急性肺损伤(acute lung injury,ALI)是脓毒症常见合并症,严重者进展为急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS),病死率可高达40%~60% [2-3]。脓毒症诱发的ALI与过度炎症反应有关[4],但具体分子机制仍未清楚。信号转导转录激活因子3(signal transducer and activator of transcription,STAT3)及细胞外信号调节蛋白激酶(extracellular signal regulated protein kinase 1/2,ERK1/2)是细胞内调控炎症产生的主要信号通路,在脓毒症相关ALI可能起重要作用[5-7]。研究报道甲基强的松龙(methylprednisolone,MP)等糖皮质激素用于脓毒症及ARDS能抑制过度炎症反应,降低死亡风险[8-10]; 但临床应用时机、剂量及抗炎机制一直存在争议[11-12]。有研究发现糖皮质激素治疗哮喘患者时能降低支气管上皮细胞的炎症因子表达,与STAT3、ERK1/2通路活性改变有关[13]。MP减轻脓毒症肺损伤是否与STAT3、ERK1/2信号通路有关,未见报道。本研究采用脂多糖(lipopolysaccharide,LPS)诱导小鼠内毒素血症引发ALI模型,探讨MP对脓毒症ALI保护作用及分子机制。
1 材料与方法 1.1 试剂与仪器脂多糖(LPS,Coli 0111:B4)(Sigma公司,圣路易市,美国); 甲基强的松龙:(辉瑞制药有限公司(进口药品注册证号:H20130301),美国); TRIzolRNA提取液(Life Technologies公司,美国); 酶联免疫吸附(ELISA)试剂盒(联科生物科技有限公司,杭州,中国); 反转录试剂盒、实时荧光定量PCR试剂盒(TaKaRa公司,大连,中国); 兔抗鼠抗GAPDH、STAT3、p-STAT3、ERK1/2及p-ERK1/2抗体(Cell Signaling Technology公司,波士顿,美国); 辣根过氧化物酶标记的山羊抗兔IgG(莱兹生物,上海,中国)。Light Cycler96实时荧光定量PCR仪(Roche公司,瑞士)。
1.2 实验动物处理8周龄雄性清洁级C57BL/6J小鼠(20~25 g)购自上海斯莱克实验动物有限公司。适应性饲养1周后随后随机(随机数字法)分为4组(每组8只):健康对照组(Control组)、LPS造模组(LPS组)、单纯MP给药组(MP组)、MP干预组(LPS+MP组)。LPS组采用腹腔注射LPS(5 mg/kg体质量)制作小鼠内毒素血症肺损伤模型,Control组注射等体积生理盐水,LPS+MP组为LPS处理lh后腹腔注射MP(2 mg/kg体质量)干预。经戊巴比妥麻醉后处死,心脏取血,室温静置0.5 h后予4℃,3 000 r/min离心15 min,保存上清液于-80℃冰箱待测; 取左肺滤纸吸干表面血液,用于测定肺组织湿/干比; 取右上肺置于4%多聚甲醛中进行固定,待HE染色; 取右肺中叶及下叶液氮瞬时冷冻后置于-80℃冰箱保存,待提取蛋白及mRNA。动物实验严格按照上海市实验动物管理条例进行,实验操作符合动物伦理学要求。
1.3 肺组织湿/干质量比检测取左肺,用滤纸吸干肺组织表面水分,称湿质量(W),置于65℃烘箱48 h至恒重(2次测定值差小于0.05 mg)后测定干质量(D),计算肺组织湿/干质量比(W/D)。
1.4 肺组织病理学检查取4%多聚甲醛固定右肺上叶组织,常规石蜡包埋、组织切片; 酒精脱蜡、二甲苯透明等处理后,待HE染色后进行肺组织病理学检查。
1.5 血清TNF-α和IL-6水平检测各组小鼠处理24 h后取血清,ELISA方法检测血清TNF-α和IL-6水平,参考试剂盒说明书进行。
1.6 肺组织TNF-α和IL-6的mRNA表达检测取右肺中叶组织以TRIzol法提取总RNA,1 μg反转录获得cDNA。实时荧光定量PCR反应条件:95℃预变性15 min,95℃变性反应10 s,60℃退火15 s,72℃延伸15 s,共45个循环。GAPDH作为内参,通过计算2-△△ct,获得TNF-α和IL-6的mRNA相对表达量。引物序列由上海生物工程有限公司合成,碱基序列见表 1。
| 基因名称 | 引物序列(5’-3’) |
| GAPDH | F:GGTTGTCTCCTGCGACTTCA |
| R:GGTCCAGGGTTTCTTACTCC | |
| TNF-α | F: CCCCAGATCTGTGTATCCTCTAA |
| R: CCCAGCATCTTGTGTTTCT | |
| IL-6 | F: GATACCACTCCCAACAGAC |
| R: CTTTTCTCATTTCCACGAT |
取右肺下叶组织加入蛋白裂解液后匀浆,4℃,12 000 r/min离心15 min,取上清液。采用BCA法定量蛋白浓度。取20 μg蛋白,行SDS-PAGE电泳,电泳分离的蛋白转至PVDF膜; 用5%的脱脂牛奶室温中封闭1 h,而后加入GAPDH、p-STAT3、STAT3、ERK1/2及p-ERK1/2的抗体,置于4℃摇床过夜孵育; TBST洗膜10 min,重复3次; 洗涤后加入二抗,室温摇床孵育l h; 洗涤后显影液显色、曝光; 实验结果用Image J图像处理软件测定蛋白条带灰度值,计算p-STAT3/STAT3及p-ERK1/2/ERK1/2灰度值的比值反映其磷酸化水平。
1.8 统计学方法计量资料经正态性检验,符合正态分布的数据以均数±标准差(Mean±SD)表示,四组小鼠肺组织W/D、血清TNF-α和IL-6水平、肺组织TNF-α和IL-6的mRNA表达及p-STAT3和p-ERK1/2蛋白表达组间均数比较采用单因素方差分析,组间两两比较采用LSD-t检验,以P < 0.05为差异有统计学意义。数据分析用SPSS v24.0软件(SPSS Inc,Chicago,IL)完成。
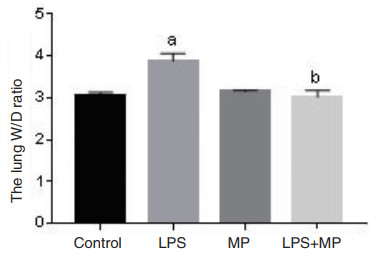
2 结果 2.1 肺组织湿/干质量比(W/D)改变LPS组肺组织W/D(3.87±0.17)与Control组(3.05±0.57))相比显著升高,而LPS+MP组肺组织W/D(3.01±0.84)较LPS组明显降低,差异具有统计学意义( F= 2.420, P= 0.038)(图 1)。
|
| 与Control组比较, aP < 0.05;与LPS组比较, bP < 0.05 图 1 各组小鼠肺组织W/D变化 Fig 1 The lung W/D ratio in mice |
|
|
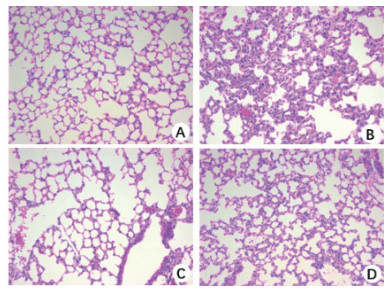
光镜下,肺组织病理切片可见对照组(A)和单纯MP组(C)小鼠的肺组织结构基本正常,肺泡腔及肺间质结构清晰,肺泡壁薄,肺泡间偶见炎性细胞浸润; LPS造模组(B)小鼠肺泡间隔增宽,肺间质水肿、炎细胞浸润,可见肺泡萎陷及肺泡内渗出性病变; 而MP干预组(D)小鼠的肺组织病理损伤程度较LPS组明显减轻,表现为肺泡间隔轻度增宽,炎症细胞浸润较LPS组明显减少,无明显肺泡萎陷,肺泡结构完整(图 2)。
|
| A:Control组(生理盐水对照组); B:LPS组(5 mg/kg 24 h处理组); C:MP组(2 mg/kg处理24 h组); D:LPS+MP组(LPS处理后1h予MP干预24 h组) 图 2 光镜下各组小鼠肺组织HE染色(× 200) Fig 2 Henntoxylin and eosin (H & E) staining in lung tissue of mice (×200) |
|
|
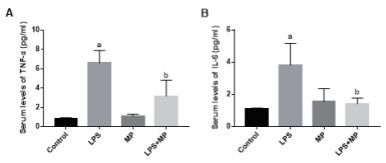
与Control组[(0.82±0.12)pg/mL,(1.12±0.02)pg/mL]相比,LPS组小鼠血清TNF-α和IL-6水平[(6.61±1.27)pg/mL,(3.80±1.35)pg/mL]显著升高。单纯MP处理组小鼠血清TNF-α和IL-6水平[(1.11±0.19)pg/mL,(1.54±0.82)pg/mL]与对照组差异无统计学意义。MP干预处理显著抑制LPS引起的小鼠血清TNF-α和IL-6水平升高[(3.17±1.64)pg/mL,(1.42±0.35)pg/mL],差异有统计学意义( F= 51.91, P= 0.003; F= 18.43, P= 0.008)(图 3)。
|
| A:血清TNF-α,B:血清IL-6。与ControlConclusions组比较, aP < 0.05;与LPS组比较, bP < 0.05 图 3 各组小鼠血清TNF-α和IL-6的水平 Fig 3 Serum levels of TNF-αand IL-6 in mice |
|
|
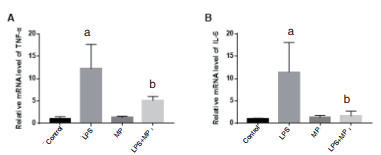
LPS处理小鼠24 h后,其肺组织内TNF-α和IL-6的mRNA表达水平(12.2±5.05, 11.12±6.56)显著高于control组(1.06±0.40,1.00±0.12); 单纯MP处理,不影响肺组织内TNF-α和IL-6 mRNA水平(1.31±0.27,1.40 ± 0.35); 而LPS+MP组TNF-α和IL-6的mRNA相对表达量(5.10±0.81,1.62±1.00)显著低于LPS组表达量,差异有统计学意义( F= 32.73,P= 0.03; F= 17.32,P= 0.026)(图 4)。
|
| A: TNF-α mRNA; B: IL-6 mRNA; 与ControlConclusions组比较, aP < 0.05;与与LPS组比较, bP < 0.05 图 4 各组小鼠肺组织TNF-α和IL-6的mRNA水平 Fig 4 The mRNA levels of TNF-α and IL-6 in lungs of mice in each group |
|
|
LPS处理24 h后,与Control组小鼠相比(0.32± 0.02, 0.34±0.14),LPS组小鼠肺组织内p-STAT3及p-ERK1/2表达水平明显上调(0.86±0.06, 1.34±0.32); 单纯MP处理组,小鼠肺组织内p-STAT3和p-ERK1/2水平不受影响(0.22±0.04, 0.40±0.04); 与LPS组比较,LPS+MP组p-STAT3及p-ERK1/2磷酸化水平显著降低(0.26 ±0.05, 0.24±0.02),差异具有统计学意义( F= 316.1,P < 0.001; F= 76.8,P < 0.001)(图 5)。
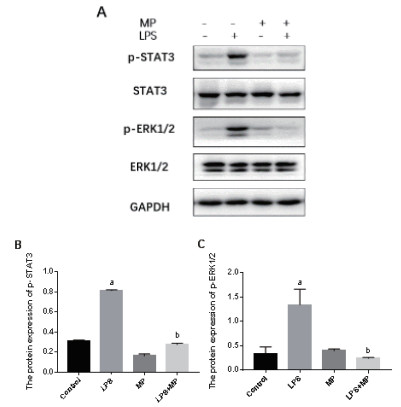
|
| A:western blotting; B:p-STAT3表达定量分析;C: p-ERK1/2表达;与Control组比较, aP< 0.05;与LPS组比较, bP< 0.05 图 5 各组小鼠肺组织p-STAT3,STAT3,p-ERK1/2和ERK1/2蛋白表达水平 Fig 5 The protein levels of p-STAT3, STAT3, p-ERK1/2 and ERK1/2 in lungs of mice in each group |
|
|
本研究选择类似于人类小剂量MP(2mg/kg)干预内毒素血症ALI模型,观察到MP可明显改善LPS诱导的小鼠ALI程度,并降低血清IL-6和TNF-α水平,抑制肺组织炎症因子IL-6和TNF-α的表达; MP抑制LPS诱导ALI肺组织中STAT3及ERK1/2的磷酸化水平; 说明MP减轻LPS肺损伤与抑制STAT3-ERK1/2信号通路降低有关。
脂多糖作为内毒素的主要成分,可以诱发“炎症瀑布反应” [14],导致肺泡毛细血管内皮细胞、肺泡上皮细胞和肺间质的急性弥漫性损害。腹腔注射LPS可用于制备ALI动物模型,W/D、肺组织病理改变可以反映肺损伤的严重程度[15]。研究表明:小鼠腹腔注射5 mg/kg的LPS可成功制备脓毒症ALI模型[16-18],本研究中使用该剂量来制备脓毒症ALI模型,24 h后观察肺组织HE染色符合ALI的病理改变,同时W/D明显升高说明ALI模型制造成功。
糖皮质激素(GC)作为有效的抗炎药物用于脓毒症的辅助治疗,其剂量、疗效等一直存在争议[8, 12, 19-20]。甲基强的松龙(methylprednisolone)是临床常用的糖皮质激素类型。临床研究表明给予脓毒症肺损伤患者静脉滴注2 mg/(kg·d) MP可以改善预后,降低病死率[8]; 也有研究表明,腹腔注射5 mg/kg MP 18 h后可有效缓解LPS诱导的肺组织损伤及炎症反应[18]。笔者的前期研究证实:小剂量2 mg/kg MP干预能有效保护LPS诱导的肝损伤[21]。本研究采用LPS造模1h后进行腹腔注射MP(2 mg/kg)进行干预,结果证实,该剂量MP可以显著抑制肺部炎症因子TNF-α及IL-6的表达,减轻小鼠肺损伤。
JAK/STAT信号通路是多种细胞因子信号转导的共同通路之一,STAT3为该通路重要成员; ERK1/2是丝裂原活化蛋白激酶(mitogen-activated protein kinases,MAPK)家族的经典转导通路之一,研究证实两者在炎症反应的过程中活化增强,介导炎症级联反应,与LPS诱发的ALI及ARDS密切关系[22-24]。Zhao等[25]发现STAT3抑制剂LLL12可以抑制LPS诱导ALI模型血清及肺泡灌洗液中早期促炎因子表达,减轻的炎症反应; Lee等[26]研究结果类似; 以上研究表明STAT3信号通路的激活参与肺损伤引起的炎症反应,而抑制其活性可降低肺部炎症反应。本研究结果显示:LPS诱导的小鼠肺组织p-STAT3蛋白表达明显增加,给予MP干预后,p-STAT3表达下降,同时伴随早期炎性细胞因子TNF-α及IL-6的表达减少,提示MP减轻炎症反应发挥肺保护作用可能与抑制STAT3磷酸化有关。Schuh等[23]研究发现LPS诱导大鼠发生ALI时,肺组织p-ERK的蛋白表达水平明显增加,给予ERK1/2抑制剂特异性阻断ERK通路后可以显著减弱大鼠肺部损伤和炎症反应。本实验MP干预组p-ERK1/2蛋白表达显著下降,肺组织炎症反应明显减轻,提示MP可能通过阻断ERK信号通路改善LPS诱导的炎症反应,进而发挥肺保护作用。
此外,STAT3和ERK1/2通路之间存在交互调控,ERK1/2可能是调节STAT3活性的上游通路信号之一[27-28]。Kakisis等[29]研究发现抑制ERK1/2活化可以阻止STAT3的丝氨酸磷酸化。本实验中,在LPS诱导小鼠发生ALI后给予MP干预,肺组织p-STAT3及p-ERK1/2蛋白表达均下降,MP抑制ERK激活和STAT3活性,两者之间的调控关系仍需进一步深入研究与探讨。
| [1] | Singer M, Deutschman CS, Seymour CW, et al. The Third International Consensus Definitions for Sepsis and Septic Shock (Sepsis-3)[J]. JAMA, 2016, 315(8): 801-810. DOI:10.1001/jama.2016.0287 |
| [2] | Mikkelsen ME, Shah CV, Meyer NJ, et al. The epidemiology of acute respiratory distress syndrome in patients presenting to the emergency department with severe sepsis[J]. Shock, 2013, 40(5): 375-381. DOI:10.1097/SHK.0b013e3182a64682 |
| [3] | Zhu CP, Wu XH, Liang YT, et al. The mortality of patients in a pediatric emergency department at a tertiary medical center in China: An observational study[J]. World J Emerg Med, 2015, 6(3): 212-216. DOI:10.5847/wjem.j.1920-8642.2015.03.009 |
| [4] | Robb CT, Regan KH, Dorward DA, et al. Key mechanisms governing resolution of lung inflammation[J]. Semin Immunopathol, 2016, 38(4): 425-448. DOI:10.1007/s00281-016-0560-6 |
| [5] | Victoni T, Gleonnec F, Lanzetti M, et al. Roflumilast N-oxide prevents cytokine secretion induced by cigarette smoke combined with LPS through JAK/STAT and ERK1/2 inhibition in airway epithelial cells[J]. Plos One, 2014, 9(1): e85243. DOI:10.1371/journal.pone.0085243 |
| [6] | Kimura A, Naka T, Muta T, et al. Suppressor of cytokine signaling-1 selectively inhibits LPS-induced IL-6 production by regulating JAK-STAT[J]. Proc Natl Acad Sci, 2005, 102(47): 17089-17094. DOI:10.1073/pnas.0508517102 |
| [7] | Wei M, Gong YJ, Tu L, et al. Expression of phosphatidylinositol-3 kinase and effects of inhibitor Wortmannin on expression of tumor necrosis factor-alpha in severe acute pancreatitis associated with acute lung injury[J]. World J Emerg Med, 2015, 6(4): 299-304. DOI:10.5847/wjem.j.1920-8642.2015.04.009 |
| [8] | Meduri GU, Headley AS, Golden E, et al. Effect of prolonged methylprednisolone therapy in unresolving acute respiratory distress syndrome: a randomized controlled trial[J]. JAMA, 1998, 280(2): 159-165. DOI:10.1001/jama.280.2.159 |
| [9] | Meduri GU, Golden E, Freire AX, et al. Methylprednisolone infusion in early severe ARDS: results of a randomized controlled trial[J]. Chest, 2007, 131(4): 954-963. DOI:10.1378/chest.06-2100 |
| [10] | 熊熙, 任玉倩, 王春霞, 等. 甲基强的松龙激活肝细胞自噬改善脂多糖诱导的肝损伤[J]. 中华急诊医学杂志, 2017, 26(12): 1407-1412. DOI:10.3760/cma.j.issn.1671-0282.2017.12.015 |
| [11] | Khilnani GC, Hadda V. Corticosteroids and ARDS: A review of treatment and prevention evidence[J]. Lung India, 2011, 28(2): 114. DOI:10.4103/0970-2113.80324 |
| [12] | Boyle AJ, Sweeney RM, McAuley DF. Pharmacological treatments in ARDS; a state-of-the-art update[J]. BMC Med, 2013, 11: 166. DOI:10.1186/1741-7015-11-166 |
| [13] | Zijlstra GJ, Fattahi F, Rozeveld D, et al. Glucocorticoids induce the production of the chemoattractant CCL20 in airway epithelium[J]. Eur Respir J, 2014, 44(2): 361-370. DOI:10.1183/09031936.00209513 |
| [14] | Alexander C, Rietschel ET. Bacterial lipopolysaccharides and innate immunity[J]. J Endotoxin Res, 2001, 7(3): 167-202. DOI:10.1179/096805101101532675 |
| [15] | Matute-Bello G, Frevert CW, Martin TR. Animal models of acute lung injury[J]. Am J Physiol Cell Mol Physiol, 2008, 295(3): L379-L399. DOI:10.1152/ajplung.00010.2008 |
| [16] | Yang RH, Yang LN, Shen XC, et al. Suppression of NF-κB pathway by crocetin contributes to attenuation of lipopolysaccharide-induced acute lung injury in mice[J]. Eur J Pharmacol, 2012, 674(2/3): 391-396. DOI:10.1016/j.ejphar.2011.08.029 |
| [17] | Li XJ, Liu DP, Chen HL, et al. Lactoferrin protects against lipopolysaccharide-induced acute lung injury in mice[J]. Int Immunopharmacol, 2012, 12(2): 460-464. DOI:10.1016/j.intimp.2012.01.001 |
| [18] | Tu GW, Shi Y, Zheng YJ, et al. Glucocorticoid attenuates acute lung injury through induction of type 2 macrophage[J]. J Transl Med, 2017, 15(1): 181. DOI:10.1186/s12967-017-1284-7 |
| [19] | Steinberg KP, Hudson LD, Goodman RB, et al. Efficacy and safety of corticosteroids for persistent acute respiratory distress syndrome[J]. N Engl J Med, 2006, 354(16): 1671-1684. DOI:10.1056/nejmoa051693 |
| [20] | Tang BMP, Craig JC, Eslick GD, et al. Use of corticosteroids in acute lung injury and acute respiratory distress syndrome: A systematic review and meta-analysis[J]. Crit Care Med, 2009, 37(5): 1594-1603. DOI:10.1097/ccm.0b013e31819fb507 |
| [21] | Li J, Cui Y, Ren Y, et al. Glucocorticoids alleviates lipopolysaccharide-induced acute liver injury associated with promoting the expression of NTCP and BSEP[J]. Int J Clin Exp Med, 2017. |
| [22] | Severgnini M, Takahashi S, Rozo LM, et al. Activation of the STAT pathway in acute lung injury[J]. Am J Physiol Cell Mol Physiol, 2004, 286(6): L1282-L1292. DOI:10.1152/ajplung.00349.2003 |
| [23] | Schuh K, Pahl A. Inhibition of the MAP kinase ERK protects from lipopolysaccharide-induced lung injury[J]. Biochem Pharmacol, 2009, 77(12): 1827-1834. DOI:10.1016/j.bcp.2009.03.012 |
| [24] | 王露, 罗科, 卿国忠, 等. 沐舒坦预处理对小鼠脓毒症所致肺损伤时p38丝裂原活化蛋白激酶通路的影响[J]. 中华急诊医学杂志, 2018, 27(3): 283-288. DOI:10.3760/cma.j.issn.1671-0282.2018.03.011 |
| [25] | Zhao JP, Yu H, Liu YD, et al. Protective effect of suppressing STAT3 activity in LPS-induced acute lung injury[J]. Am J Physiol Cell Mol Physiol, 2016, 311(5): L868-L880. DOI:10.1152/ajplung.00281.2016 |
| [26] | Kang K. Janex-1, a JAK3 inhibitor, ameliorates tumor necrosis factor-α-induced expression of cell adhesion molecules and improves myocardial vascular permeability in endotoxemic mice[J]. Int J Mol Med, 2012, 29(5): 864-870. DOI:10.3892/ijmm.2012.920 |
| [27] | Jain N, Zhang T, Fong SL, et al. Repression of Stat3 activity by activation of mitogen-activated protein kinase (MAPK)[J]. Oncogene, 1998, 17(24): 3157-3167. DOI:10.1038/sj.onc.1202238 |
| [28] | Chung J, Uchida E, Grammer C, et al. STAT3 serine phosphorylation by ERK-dependent and -independent pathways negatively modulates its tyrosine phosphorylation[J]. Mol Cell Biol, 1997, 17(11): 6508-6516. DOI:10.1128/mcb.17.11.6508 |
| [29] | Kakisis JD, Pradhan S, Cordova A, et al. The role of STAT-3 in the mediation of smooth muscle cell response to cyclic strain[J]. Int J Biochem Cell Biol, 2005, 37(7): 1396-1406. DOI:10.1016/j.biocel.2005.01.009 |
 2019, Vol. 28
2019, Vol. 28




