2 徐州医科大学盐城临床学院(盐城市第一人民医院), 盐城 224000;
3 枣矿集团中心医院神经内科,枣庄 277800;
4 广州市第一人民医院 神经外科,510180;
5 上海市徐汇区中心医院神经外科,200031
2 Department of Emergency, Yancheng Clinical Institute, Xuzhou Medical University (Yancheng City No.1 People's Hospital), Yancheng, JiangSu Province China;
3 Department of Neurology, Shandong Eenergy Zaozhuang Mining Group Central Hospital, Zaozhuang, Shandong Province, China;
4 Department of Neurosurgery, Guangzhou First People's Hospital, Guangzhou, Guangdong Province, China;
5 Department of Neurosurgery, Shanghai Xuhui Central Hospital, Shanghai, China
恶性大脑中动脉梗死(malignant middle cerebral artery infarction, MMI),是早期迅速进展的占位性脑水肿,引起难治性颅高压, 导致在发病后的24~72 h迅速出现神经功能恶化和脑疝形成的一种特殊类型的大面积脑梗死(large hemisphere infarction,LHI)[1],又称脑疝型大面积脑梗死。即使经过最佳的保守治疗,其病死率仍高达80%,存活患者仍留有严重的残疾[2]。通过去骨瓣减压手术(decompressive Hemicraniectomy, DHC)控制颅内压可以将MMI病死率从70%降至22%[3-6],但该手术创伤大,并发症多[7],对于年老体质虚弱的患者常常不能耐受,研究显示>60岁的MMI,DHC虽能降低病死率,但6个月的病死率仍高达33%,远期预后良好率(mRS≤3)仅为6%[8-10],未显示与内科保守组有统计学意义,因此2018年AHA/ASA指南从挽救生命角度考虑,对 > 60岁MMI可考虑DHC,但推荐级别极低,仅为Ⅱb推荐[11],因此DHC治疗老年MMI仍存在争议。进一步探索更加微创、更加有效的治疗方法具有更重要的意义。方体定向置管抽吸引流术能是治疗脑出血的一种有效的治疗方法,运用该方法抽吸坏死脑组织治疗MMI目前研究较少,理论上抽吸一定量的坏死脑组织通过内减压可以有效控制颅高压,但考虑到MMI本身的高出血转化的风险,加之非直视下抽吸负损伤可能增加出血风险,正是基于出血风险的担忧,限制了该方法在MMI中的应用。但是MMI之所以不同于其他大面积脑梗死,快速形成脑疝,其特殊的病理生理特点为主干血管的急性闭塞与侧支循环的缺失共同协同,导致缺血组织处于广泛而严重的缺血状态甚至无血流状态,基于对MMI病理生理特殊性的理解,在血管再通前严格控制出血风险的前提下,行抽吸坏死脑组织理论上不应增加有临床意义出血的风险。笔者从2017年06月至2019年01月采用方体定向抽吸术治疗16例MMI取得了显著效果,并具有良好的安全性,现报道如下。
1 资料与方法 1.1 一般资料方体定向置管抽吸坏死脑组织减容减压术入选患者参照MMI去骨瓣减压手术标准[12]制定:①年龄>60岁的老年患者,临床表现为完全性偏瘫、偏身感觉障碍、偏盲、凝视障碍,并伴有失语、意识障碍等高级神经功能障碍,NIHSS评分 > 15分,估计为大面积脑梗死,后均经头颅MRI或CT证实:大脑中动脉供血区域2/3, 伴或不伴有同侧大脑前动脉和(或)大脑后动脉供血区域受累; ②一旦诊断为MMI,手术在发病后24~48 h内尽快手术; ③所有手术患者术前必须经CTA证实,供应梗死区域的大血管闭塞; ④经患者家属同意并签署手术知情同意书,该研究经医院伦理委员会批准进行。排除标准:①既往有卒中病史,并遗留严重后遗症的患者; ②双侧大脑半球急性梗死; ③静脉溶栓和(或)动脉溶栓或机械取栓; 出血转化并导致严重的占位效应; ④发病超过48 h的MMI,被排除; ⑤术前CTA证实闭塞大血管再通,将被排除; ⑥双瞳散大、脑干功能衰竭; ⑦凝血功能异常或患有凝血疾病。
符合以上纳入标准,在发病后24~48 h,一旦被诊断为MMI,立即行定向置管抽吸坏死脑组织减容减压术。共手术16例,其中男9例,女7例。年龄61~80岁,(67.9±6.4)岁。左侧半球11例,右侧半球5例。术前格拉斯哥评分(Glasgow Coma Scale, GCS)9~12分6例,6~8分6例,3~5分4例。术前一侧瞳孔散大2例。术前NIHSS评分为(30.8±3.8)分。既往高血压病史11例,糖尿病3例,房颤8例。
1.2 方法术前给予控制脑水肿,监护生命体征,开放气道,保留导尿,胃肠减压,深静脉置管; 充分镇静、镇痛、止吐; 管理血压; 防治并发症与营养支持等内科常规治疗。所有病例先给予梗死对侧的侧脑室置管,释放脑脊液5~10 mL,颅内压降至20 mmHg以防止脑疝。后行定向置管抽吸坏死脑组织减容减压术。采用利多卡因局麻6例,在气管插管呼吸机辅助下运用丙泊酚辅助静脉麻醉10例。
完成侧脑室置管后行定向置管抽吸坏死脑组织减容减压术:(1)采用中国大连七颗星医疗器械有限公司生产的脑内血肿定向软通道微创手术器械,根据孙树杰方体定向血肿清除原理[13],参考患者头部CT,准确测量梗死灶三维数据,确定靶点数通常为1~3个靶点及其入颅路径,穿刺路径中注意避开外侧裂血管。(2)利用颅脑立体定位尺,采用“头部立体画线法”,在头部画出颅表穿刺点、穿刺方向线所在的水平面、冠状面、矢状面。(3)确定穿刺点后,贴上金属标志物,再次复查头颅CT以确定定位是否准确。(4)常规消毒局麻后,颅钻沿穿刺方向钻一直径约7 mm骨孔,待穿破骨质有突破感后,拔除定向颅钻,用凹颅钻清理骨孔内骨屑,然后置入锁孔器。(5)通过锁孔器用脑膜穿刺针扎破硬脑膜; 后用三级光滑的探棒缓慢沿锁孔器方向逐级扩张,建立预通道。(6)将软管置入梗死组织中,用20 mL注射器抽吸坏死脑组织,抽吸结束后给予生理盐水500 mL加肾上腺素2 mg冲洗,确认无活动性出血后,接引流袋,持续开放引流。术后2~5 d根据头颅CT占位效应及颅高压情况,可重复应用注射器抽吸坏死脑组织。一般置管引流5~7 d,临床症状好转,复查头颅CT,占位效应及中线结构移位缓解,颅内压监测显示低于20 mmHg,可考虑拨除引流管,见图 1。
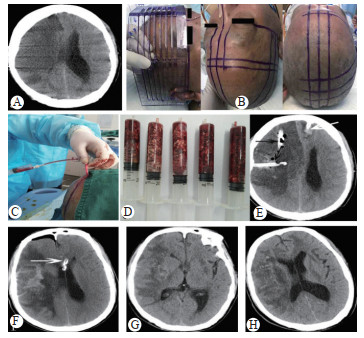
|
| 患者,男,65岁,因”意识障碍18 h ”入院。A:术前头颅CT见右侧大脑中动脉伴大脑前动脉供血区大面积低密度灶,中线结构移位10 mm; B:术前利用颅脑立体定位尺画线; C:术中抽吸脑组织; D:共抽吸80 mL坏死脑组织; E:术后复查头颅CT共置入三根引流管,对侧侧脑室内置入颅内压监测管(白色箭头),梗死灶内置入引流管(黑色箭头); F:术后1周复查头颅CT,侧脑室内留有颅内压监测管(白色箭头)用以监测颅内压,病灶内两根引流管已拔除,中线结构无移位,颅内积气显示颅内压低,颅骨完整; G:术后两周CT示引流管已全部拔出,中线无偏移,结构完整; H:患者术后20 d出院前的头颅CT 图 1 右侧侧脑室置管颅内压监测+双靶点定向置管抽吸坏死脑组织 Fig 1 Right lateral ventricular catheter for intracranial pressure monitoring + double target cuboid stereotactic aspiration of necrotic brain tissue |
|
|
16例患者中,一次手术抽吸11例,两次手术抽吸5例。前后共穿刺靶点数目:单靶点3例,双靶点9例,三靶点4例。首次抽吸量平均为(54.6±11.4) mL,总抽吸量(60.9±12.8)mL。通过术后1~2次手术,充分脱水和脑脊液间歇释放等措施,所有病例ICP均维持在20 mmHg以下。1个月存活13例(81.25%),死亡3例(18.75%)。1例死于手术路径穿过正常脑组织导致术后再出血,2例死于肺部感染。无颅内感染。随访6个月采用改良Rankin量表(modified rankin scale, mRS)评估患者疗效。16例患者中,3分(中度残疾)6例(37.5%); 4分(重度残疾)6例(37.5%); 5分(严重残疾+植物状态)1例(6.25%); 6分(死亡)3例(18.75%),将mRS≤3定义为预后良好,6个月的预后良好率为37.5%,6个月的病死率为18.75%。
3 讨论本研究初步显示发病后24~48 h内早期进行定向置管抽吸坏死脑组织治疗老年(>60岁)MMI患者是安全有效的。>60岁的老年MMI患者占所有MMI患者的50%。尽管DHC是控制MMI颅高压的有效措施,但是由于创伤大,并发症多,对于老年MMI患者疗效并不理想。以>60岁MMI为研究对象的DESTINY Ⅱ[14]研究结果显示DHC与保守组的6个月病死率分别为33%和70%,有统计学意义。但是主要终点指标预后良好率(mRS 0~3)DHC组和保守组分别为7%和3%,差异无统计学意义。本研究显示抽吸组6个月的病死率、mRS 0~4、预后良好率(mRS 0~3)分别为18.75%、75%、37.5%,与DHC组(33%、39%、7%)和保守组(70%、18%、3%)比较差异有统计学意义(P<0.001)(见表 1)。本研究初步显示采用方体定向抽吸术治疗老年MMI,能降低其病死率,并能改善其远期预后。
| 指标 | 去骨瓣减压组(n= 49) | 内科保守组(n= 63) | 抽吸组(n= 16) | 统计量 | P值 |
| mRS 0~2 | 0 | 0 | 0 | Kruskal-wallis test χ2=26.08 | P<0.001 |
| mRS 3 | 3(7%) | 2(3%) | 6(37.5%) | ||
| mRS 4 | 16(32%) | 9(15%) | 6(37.5%) | ||
| mRS 5 | 14(28%) | 8(13%) | 1(6.25%) | ||
| mRS 6 | 16(33%) | 44(70%) | 3(18.75) | ||
| 死亡 | 16(33%) | 44(70%) | 3(18.75) | χ2=22.04 | P<0.001 |
| mRS 0~4 | 19(39%) | 11(18%) | 12(75%) | χ2=20.44 | P<0.001 |
| mRS 0~3 | 3(7%) | 2(3%) | 6(37.5%) | χ2=19.76 | P<0.001 |
| mRS, modified Rankin Scale. DESTINY Ⅱ, Decompressive Surgery for the Treatment of Malignant Infarction of the Middle Cerebral Artery Ⅱ. |
|||||
该手术最大担心的是安全问题,即有临床意义出血风险是否增加。但本研究中并没有发现有意义出血的风险增加。究其原因,主干血管闭塞与侧支循环的严重缺如(急性闭塞+先天性的侧支循环缺失),导致MCA供血区域组织极其严重的同步缺血,同步坏死,同步水肿,导致恶性颅内压增高,是MMI快速脑疝形成的病理生理基础。这样的病理生理基础也提示坏死脑组织较非MMI的大面积脑梗死处于更加严重的缺血状态,甚至无血流状态[15],这种病理生理的特殊性可能是早期大量抽吸坏死脑组织过程中未发生出血的重要机制。由于MMI高出血转化的风险的担心限制了该手术的使用,但是MMI梗死后出血转化高峰期主要发生在4~7 d[16-17], 在48 h内发生梗死后出血的风险极低。本组病例手术时机均在48 h内完成,并经过CTA证实血管闭塞,在血管再通与侧支循环未建立前进行抽吸,也是抽吸不增加出血风险的另一个机制。我们在大面积脑梗死DHC中在直视下尝试抽吸坏死脑组织,发现瘀滞在坏死脑组织中的陈旧血液渗出,经生理盐水冲洗即可清除干净,并没有发现新鲜出血的现象。
为了避免术中出血风险,手术技巧应需要注意:(1)在抽吸的过程中须避免损伤正常脑组织,抽吸的目标必须要经磁共振DWI序列或CT证实为坏死组织。(2)穿刺需要避开外侧裂血管,颅表穿刺点常选择:前部为额结节附近,后部为顶结节附近,中部为眦听线5 cm以上的顶部附近; (3)尽可能在48 h内早期给予减容减压手术治疗,参照去骨瓣减压的手术指征,一旦被确认为MMI,尤其是发病14 h内弥散加权成像 > 140 mL(预测MMI敏感度100%,特异度94%)[18],可考虑立即手术,不必等到中线结构移位超过5 cm。早期手术避免闭塞血管再通和侧支循环的形成,可减少术中出血风险。(4)为防止术中出血,围手术期血压的管理也非常重要,一般血压控制在收缩压在140~160 mmHg,脑灌注压在50~70 mmHg[19]。(5)另外,术中如发现活动性出血,予生理盐水双管对流冲洗,在本研究中都能停止。
本研究发现抽吸坏死脑组织能够有效地防治脑水肿、控制颅内压。其控制颅内压的主要机制可能为:(1)抽吸坏死脑组织,减少脑容量,降低颅内压。(2)消除了已去除的坏死组织的后期的水肿反应,同时减少了坏死组织所释放的毒性物质如白三烯、白介素、血小板活化因子等,对周围正常组织的损伤; (3)通过保留导管可见引流液引出,提示坏死细胞的细胞膜破坏和通透性增加,引起细胞间质水肿,或者脑脊液渗透到坏死区域,通过引流液的排出,进一步减少脑容量,增加代偿空间。尽管定向置管抽吸坏死脑组织能明显减轻脑水肿,但是仅靠此手术有可能不能完全达到控制颅内压的目的,为了进一步控制颅内压防止脑疝,所有病例联合侧脑室置管颅内压监测更有利于精确地指导间断性脑室外引流和脱水剂使用,以控制颅内压,帮助患者度过脑水肿高峰。
关于抽吸量的问题。抽吸量过小达不到有效地降低颅内压的目的,本组病例首次抽吸量平均为(54.6±11.4) mL,总抽吸量(60.9±12.8) mL。本研究发现平均每个靶点的抽吸量约20~40 mL,再增加抽吸量是很困难的。为了提高抽吸效率,首次抽吸常需要双靶点抽吸,甚至三靶点抽吸; 要沿着穿刺路径由深到浅逐层抽吸,而不是定点抽吸,有助于提高抽吸量。抽吸过程中不停地旋转导管,利用导管侧孔对坏死脑组织的机械性切割作用,可以增加抽吸效能。
总之,本研究初步显示方体定向抽吸术治疗MMI可能是一种简单、微创、安全、有效的治疗方法,尚需要更严格的设计和大样本的随机对照试验研究进一步证实。
| [1] | Treadwell SD, Thanvi B. Malignant middle cerebral artery (MCA) infarction: pathophysiology, diagnosis and management[J]. Postgrad Med J, 2010, 86(1014): 235-242. DOI:10.1136/pgmj.2009.094292 |
| [2] | Hwang DY, Matouk CC, Sheth KN. Management of the malignant middle cerebral artery syndrome[J]. Semin Neurol, 2013, 33(5): 448-455. DOI:10.1055/s-0033-1364211 |
| [3] | Jüttler E, Schwab S, Schmiedek P, et al. Decompressive surgery for the treatment of malignant infarction of the middle cerebral artery (DESTINY): a randomized, controlled trial[J]. Stroke, 2007, 38(9): 2518-2525. DOI:10.1161/STROKEAHA.107.485649 |
| [4] | Vahedi K, Vicaut E, Mateo J, et al. Sequential-design, multicenter, randomized, controlled trial of early decompressive craniectomy in malignant middle cerebral artery infarction (DECIMAL Trial)[J]. Stroke, 2007, 38(9): 2506-2517. DOI:10.1161/STROKEAHA.107.485235 |
| [5] | Hofmeijer J, Kappelle LJ, Algra A, et al. Surgical decompression for space-occupying cerebral infarction (the Hemicraniectomy After Middle Cerebral Artery infarction with Life-threatening Edema Trial[HAMLET]): a multicentre, open, randomised trial[J]. Lancet Neurol, 2009, 8(4): 326-333. DOI:10.1016/S1474-4422(09)70047-X |
| [6] | Torbey MT, Bösel J, Rhoney DH, et al. Evidence-based guidelines for the management of large hemispheric infarction : a statement for health care professionals from the Neurocritical Care Society and the German Society for Neuro-intensive Care and Emergency Medicine[J]. Neurocrit Care, 2015, 22(1): 146-164. DOI:10.1007/s12028-014-0085-6 |
| [7] | Kurland DB, Khaladj-Ghom A, Stokum JA, et al. Complications associated with decompressive craniectomy: A systematic review[J]. Neurocrit Care, 2015, 23(2): 292-304. DOI:10.1007/s12028-015-0144-7 |
| [8] | Maciel CB, Sheth KN. Malignant MCA Stroke: an update on surgical decompression and future directions[J]. Curr Atheroscler Rep, 2015, 17(7): 40. DOI:10.1007/s11883-015-0519-4 |
| [9] | Yang MH, Lin HY, Fu J, et al. Decompressive hemicraniectomy in patients with malignant middle cerebral artery infarction: A systematic review and meta-analysis[J]. Surgeon, 2015, 13(4): 230-240. DOI:10.1016/j.surge.2014.12.002 |
| [10] | Sundseth J, Sundseth A, Jacobsen EA, et al. Predictors of early in-hospital death after decompressive craniectomy in swollen middle cerebral artery infarction[J]. Acta Neurochir (Wien), 2017, 159(2): 301-306. DOI:10.1007/s00701-016-3049-0 |
| [11] | Furie KL, Jayaraman MV. 2018 Guidelines for the Early Management of Patients With Acute Ischemic Stroke[J]. Stroke, 2018, 49(3): 509-510. DOI:10.1161/STROKEAHA.118.020176 |
| [12] | Taylor B, Lopresti M, Appelboom G, et al. Hemicraniectomy for malignant middle cerebral artery territory infarction: an updated review[J]. J Neurosurg Sci, 2015, 59(1): 73-78. |
| [13] |
孙树杰, 崔明, 隋韶光, 等. 方体定向血肿吸引术治疗高血压患者壳核出血[J].
中华老年心脑血管病杂志, 2012, 14(1): 5-7.
S Shu-jie, C Ming, S Shao-guang, et al. Treatment of hypertensive putamen hemorrhage in gerontal patient by cuboid stereotactic catheter indwelt hematoma aspiration[J]. Chinese Journal of Geriatric Heart Brain and Vessel Diseases, 2012, 14(1): 5-7. DOI:10.3969/j.issn.1009-0126.2012.01.002 |
| [14] | Jüttler E, Bösel J, Amiri H, et al. DESTINY Ⅱ: DEcompressive Surgery for the Treatment of malignant INfarction of the middle cerebral arterY Ⅱ[J]. Int J Stroke, 2011, 6(1): 79-86. DOI:10.1111/j.1747-4949.2010.00544.x |
| [15] | Heiss WD. Malignant MCA Infarction: Pathophysiology and Imaging for Early Diagnosis and Management Decisions[J]. Cerebrovasc Dis, 2016, 41(1-2): 1-7. DOI:10.1159/000441627 |
| [16] | Chen G, Wang A, Zhao X, et al. Frequency and risk factors of spontaneous hemorrhagic transformation following ischemic stroke on the initial brain CT or MRI: data from the China National Stroke Registry (CNSR)[J]. Neurol Res, 2016, 38(6): 538-544. DOI:10.1080/01616412.2016.1187864 |
| [17] | Tan S, Wang D, Liu M, et al. Frequency and predictors of spontaneous hemorrhagic transformation in ischemic stroke and its association with prognosis[J]. J Neurol, 2014, 261(5): 905-912. DOI:10.1007/s00415-014-7297-8 |
| [18] | Oppenheim C, Samson Y, Manaï R, et al. Prediction of malignant middle cerebral artery infarction by diffusion-weighted imaging[J]. Stroke, 2000, 31(9): 2175-2181. DOI:10.1161/01.STR.31.9.2175 |
| [19] | Bratton SL, Chestnut RM, Ghajar J, et al. Guidelines for the management of severe traumatic brain injury. Ⅸ. Cerebral perfusion thresholds[J]. J Neurotrauma, 2007, 24(Suppl 1): S59-64. DOI:10.1089/neu.2007.9987 |
 2019, Vol. 28
2019, Vol. 28




