细胞焦亡(pyroptosis)是近年来被定义的一种新的细胞程序性死亡方式,2005年,Fink和Cookson[1]将这种依赖于半胱氨酸天冬氨酸特异性蛋白酶-1(cysteinyl aspartate specific proteinase-1,caspase-1)的细胞死亡方式区别于炎症和凋亡,取词根“pyro-”发热、火的意思,来体现这种细胞死亡方式促炎的本质,并命名为焦亡。细胞焦亡作为机体的一种保守性天然免疫机制,与多种疾病有着密切的联系,在肿瘤和免疫系统相关疾病方面的研究进展显著。脓毒症(sepsis)是一种由严重感染引起的宿主反应失调所致的致命性的多器官功能障碍综合征(multiple organ dysfunction syndrome,MODS),是ICU的常见病,病死率极高[2]。近期研究表明,细胞焦亡在脓毒症进程中也发挥了重要作用。本文就细胞焦亡及其在脓毒症中的相关研究进展做一综述。
1 焦亡的概述 1.1 焦亡的定义由于caspase家族是著名的介导细胞程序性死亡即凋亡的蛋白组,所以最初,这种新的细胞程序性死亡方式被认为是细胞坏死或者凋亡前的炎症反应过程,其相关的caspase蛋白也被归类为炎症因子[3]。直到数十年后这种由人类的caspase-1、caspase-4/-5和小鼠的caspase-1、caspase-11蛋白介导的,以细胞膜打孔和胞内大量炎症因子外溢为特点的细胞程序性死亡方式,被正式命名为焦亡[1, 4]。
1.2 焦亡的类型及其过程根据焦亡的起始激活方式不同,可将焦亡分为三种类型:刺激物激活炎症小体的经典途径,以革兰阴性杆菌脂多糖(lipopolysaccharides,LPS)为代表的刺激物直接活化caspase-11的非经典炎症小体途径以及肿瘤相关化疗药物激活的依赖caspase-3的凋亡向焦亡转化的途径。
1.2.1 经典炎症小体焦亡途径炎症小体(inflammasome)是一类在细胞质中组装的多蛋白复合物,是胞质内核苷酸结合寡聚化结构样受体(nucleotide binding oligomerization domain like receptor,NLR)家族成员,具有特异性识别功能。针对多种病原菌引起的感染性刺激和其他刺激物引起的非感染性刺激,炎症小体的形态结构各不相同[5]。目前研究较多的炎症小体包括:NOD样受体热休克蛋白结构域1(NOD-like receptor pyrin domain containing1,NLRP1)、NOD样受体热休克蛋白结构域3(NLRP3)、IL-1β转换酶蛋白激活因子(interleukin betaconverting enzyme activating factor,IPAF)和黑色素瘤缺乏因子2(absent in melanoma 2,AIM2)[6],其中NLRP3是介导细胞焦亡发生的主要炎症小体[7]。
TLRs属于模式识别受体(pattern recognition receptor,PRR),是一种跨膜蛋白,能够识别细胞外致病原,并参与激活先天免疫。研究已经证实NLRP3可被已识别病原体相关分子模式(pathogen-associated molecular patterns,PAMP)和宿主损伤相关分子模式(damage associated molecular pattern,DAMP)的PRR激活,从而介导焦亡[7]。此处以革兰阴性杆菌的脂多糖(lipopolysaccharides,LPS)为例,LPS是一种PAMP,可被TLR4特异性识别。当TLR4识别LPS后激活NLR。NLR接收刺激,通过配体识别结合ATP形成寡聚体,并与含有caspase激活和募集域(caspase activation and recruitment domain,CARD)的受体相结合,形成炎症小体。炎症小体活化caspase-1,激活的caspase-1不仅进一步切割活化下游的其他caspase执行蛋白(人类为caspase-4/-5,小鼠为caspase-11),促进白介素-1β(interleukin-1β,IL-1β)和IL-18的加工,同时也活化了更多的caspase-1达到级联放大的效应。成熟的IL-1β和IL-18并释放到胞外将募集更多的炎症细胞,扩大炎症反应。这一系列过程导致了细胞炎症程序化死亡——焦亡[8]。
Gasdermin D蛋白(GSDMD)是一类由N端和C端结构域组成的二联蛋白,caspase-1、caspase-4/-5/-11可以通过切割活化其N端,被切割后的GSDMD N端可以聚集在磷脂膜上并形成直径12~24 nm的孔道,为IL-1β和IL-18释放提供条件[8-9]。同时该通道造成胞外钠离子、钙离子内流,使细胞肿胀,在打孔处形成大泡。当仅有少量孔道形成时,细胞可以维持一个短暂的平衡,但大量孔道开放或是孔道开放时间过长,则会导致细胞崩解,胞内容物外溢产生炎症反应[10]。
1.2.2 非经典炎症小体焦亡途径LPS也可以绕过TLR4直接结合并激活小鼠的caspase-11,激活后的caspase-11切割GSDMD使其激活并使细胞进入焦亡过程,称为非经典的焦亡途径。值得注意的是,非经典途径中激活的GSDMD亦可以激活炎症小体NLRP3,从而通过经典炎症小体途径活化caspase-1,加工IL-1β和IL-18前体,进入经典的焦亡过程[11]。这种途径在人体细胞体外培养时同样可以观测到[12]。
1.2.3 凋亡蛋白caspase-3介导的焦亡途径近年来,研究人员发现,gasdermin E蛋白(GSDME)可以通过肿瘤坏死因子α(tumor necrosis factor α,TNF α)及一些化疗药物将caspase-3诱导的细胞凋亡(apoptosis)转化为细胞焦亡[13]。GSDME与GSDMD同属gasdermin家族,是该家族最古老保守的成员之一,且几乎所有的gasdermin家族成员都含有可以在磷脂膜打孔的N端结构域[14]。在凋亡发生时,化疗药物的使用和机体本身产生的TNF-α活化被caspase-3切割的GSDME,并导致其在细胞膜上打孔。电镜下观测时打孔细胞呈典型的焦亡形态学特征,即压力差导致的细胞膜上大泡形成。虽然细胞中凋亡相关蛋白几乎同时被激活,但细胞焦亡进程更快,因此细胞最终表现为焦亡[13]。细胞焦亡过程示意图见图 1。
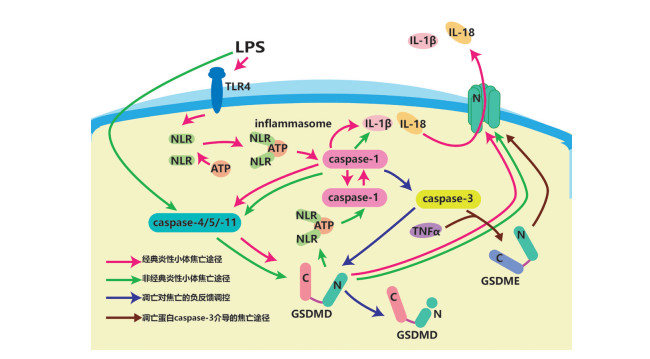
|
| 细胞焦亡可根据起始激动方式不同分为3种途径:①由刺激物激活炎症小体的经典途径,如LPS等与TLR结合,使NLR蛋白寡聚形成炎症小体并结合caspase-1,使caspase-1自行切割并活化caspase-4/-5/-11级联放大,加工IL-1β和IL-18。caspase-4/-5/-11切割并激活打孔蛋白GSDMD,在胞膜打孔使其破损,导致胞质和其中的IL-18、IL-1β释放。②非经典炎症小体途径,LPS不与TLR4结合而直接进入胞内切割caspase-4/-5/-11,caspase-4/-5/-11切割并激活打孔蛋白GSDMD,激活后的GSDMD胞膜打孔导致细胞焦亡,同时也激活炎症小体进入经典途径。③正常组织中caspase-1可以切割caspase-3,活化后的caspase-3可以切割GSDMD破坏其N端结构域,使其灭活,作为焦亡的负性调节。在TNF-α存在时caspase-3可以切割激活GDSME在胞膜打孔导致细胞焦亡 图 1 细胞焦亡的过程 |
|
|
细胞凋亡与细胞焦亡同为caspase蛋白依赖的细胞程序性死亡方式。在细胞凋亡进程中caspase-3/-6/-7蛋白被caspase-2/-8/-9/-10蛋白活化后规律切割胞内结构蛋白和DNA,被切割后的肽链和DNA片段与溶酶体结合形成自噬体,当以整个细胞为自噬对象时,胞膜皱缩分割包裹细胞内容物形成凋亡小体[15]。不同于细胞焦亡和坏死,细胞凋亡的过程中细胞膜未被破坏而是被吞噬细胞吞噬降解,没有胞质外溢,故而不产生炎症反应。
2.2 焦亡与坏死在细胞受到损伤如病原体感染和(或)理化性质损害等时,聚ADP-核糖聚合酶(poly ADP-ribose polymerase PARP)参与DNA修复。然而,随着DNA的大量破坏,过量的PARP被激活、ATP消耗,最终导致细胞因能量储存耗竭,细胞器肿胀,起泡和增加膜通透性,最终导致细胞膜破裂,胞内容物释放即细胞的坏死(necrosis)[4]。在自噬受到抑制时,细胞内产生的大量自噬体不能及时与溶酶体融合导致自噬体破裂、内容物溢出,进入继发的凋亡性坏死(apoptotic necrosis)阶段[16-18]。此外,由于焦亡发生时也有细胞膜完整性破坏,胞内容物的外溢,所以也有学者将其称为焦性坏死或者炎症坏死(pyroptotic necrosis)[19]。
2.3 焦亡与自噬自噬(autophagy),可分为特异性自噬和非特异性自噬两类。非特异性自噬,主要见于饥饿状态下,机体拆解胞内物质为细胞的存活提供能量和必需营养要素的过程。特异性自噬又可以分为异食(xenophagy)和线粒体自噬(mitophagy)。异食清除的是病原微生物及其分泌的病原模式分子等外来物质[20]。线粒体自噬是细胞通过分子伴侣介导的以目标线粒体为靶点,清除受损细胞器的过程[21]。自噬作为机体生长发育过程中的一种重要的保护机制,是机体免疫调控、维持细胞内稳态和处理垃圾的重要途径[22],是焦亡、凋亡和坏死这三种不同受损细胞预后的主要转归节点和重要联系。焦亡、凋亡和坏死的区别与联系见表 1。
| 因素 | 焦亡 | 凋亡 | 坏死 | 自噬 |
| 程序性 | 是 | 是 | 否 | 是 |
| 启动蛋白 | caspase-1 | caspase-2/-8/-9/-10 | - | Caspase-3/-8 |
| 执行蛋白 | Caspase-4/-5/-11 | Caspase-3/-6/-7 | - | Atg家族 |
| 细胞膜完整 | 否 | 是 | 否 | 是 |
| 炎症因子释放 | 是 | 否 | 是 | 否 |
| 细胞结局 | 死亡 | 死亡 | 死亡 | 存活或死亡 |
caspase-1切割其下游caspase-4/-5(小鼠中为caspase-11)的同时也非选择性地切割caspase-3/-7,被切割的caspase-3/-7则竞争性地切割GSDMD使其失活,阻止caspase-1介导的焦亡进程,通过负反馈调节,抑制焦亡和炎症[23]。同样,在敲除GSDMD的小鼠和细胞中,炎症小体和caspase-1诱导细胞凋亡而非焦亡[9, 13]。
3.2 细胞凋亡抑制细胞焦亡已知化疗药物或TNF-α可以刺激凋亡蛋白caspase-3切割GSDME从而使细胞凋亡向焦亡转变外,细胞焦亡和凋亡在其他通路层面也存在着拮抗和转化[13]。体外试验表明,正常凋亡的发生对焦亡有特异的抑制作用。研究人员发现,caspase-3和部分caspase-7可以切割GSDMD蛋白87位点的天冬氨酸,使其N端细胞毒性片段p30失活,阻止细胞进入焦亡过程,细胞凋亡得以继续[23]。
3.3 自噬抑制细胞焦亡LPS结合TLR4是经典炎症小体焦亡途径的初始环节,同样也是多种自噬相关信号通路的主要触发点[24]。Kim等[25]发现,在肺炎链球菌感染小胶质细胞实验中,过表达自噬相关蛋白可减少细胞焦亡,而抑制自噬则促进感染细胞中caspase-1表达增加和IL-18释放增强。Pu等[26]发现自噬相关蛋白7(autophagy-related protein 7,Atg7)的缺失可以导致铜绿假单胞菌感染的小鼠体内炎症小体不受控制地激活。这些研究成果提示自噬可能通过清除体内刺激因素来减少炎症小体的活化从而实现对细胞焦亡的负调节作用。
4 脓毒症中焦亡的发生及相关机制脓毒症是以早期的高炎症反应和随之而来的严重免疫抑制为主要特征的涉及多脏器功能损害的严重疾病[27],在各级医疗机构和ICU中有着较高的致病率和致死率[28-29],目前临床上对于脓毒症的治疗方案仍以对症支持治疗为主。基础研究认为,脓毒症病程主要由初期感染或其他重大打击导致高炎症期和随着机体炎症因子、溶酶体、免疫细胞耗竭带来的免疫抑制二次感染期组成[30]。
4.1 细胞焦亡在脓毒症病程中的相关作用焦亡无需特异性的DNA片段分割的特点使得该过程中细胞裂解速度远远快于细胞凋亡。此外,caspase-1自体活化级联的速度也快于其非特异性切割caspase-3/-7的速度。可见,病原体感染的初始阶段以焦亡为主[9]。2015年邵峰院士团队在脓毒症病程中证实caspase-1、caspase-4/-5/-11可以通过切割GSDMD蛋白活化其N端,激活后的GSDMD蛋白片段可以在细胞膜上打孔,从真核细胞内部破坏细胞膜。胞膜破裂后造成含有大量的炎症因子(如IL-1β、IL-18等)的胞质外溢,从而引起炎症反应[9]。
这一发现表明,焦亡在脓毒症的极早期即可出现。一方面经典炎症小体焦亡途径可通过IL-1β和L-18等炎症因子快速启动机体免疫应答,加强宿主自身的抗感染能力。另一方面非经典炎症小体焦亡途径除了能释放炎症因子启动免疫应答外,还通过裂解细胞使胞内细菌暴露从而被免疫细胞识别清除。由此可见,当焦亡发生于感染的初始阶段,对于机体有着明显的保护性作用。而在脓毒症期,焦亡则是瀑布式炎症反应的起始阶段,是把“双刃剑”。
4.2 调控焦亡对于脓毒症病程的影响Wang等[16]的研究发现,敲除caspase-11和GSDMD的细胞接受刺激后不会进入焦亡阶段,而是进行经典的凋亡过程。邵峰院士团队同样发现,敲除caspase-11和GSDMD的小鼠经LPS诱导革兰阴性杆菌脓毒症模型,其与对照组相比存活率显著提高[9]。Song等[31]则报道了,在大肠杆菌感染小鼠的模型中,鞘氨醇-1-磷酸受体2(sphingosine-1-phosphate receptor 2,S1PR2)缺陷小鼠的caspase-11产生减少,巨噬细胞焦亡明显下降,存活率上升。
上述研究结果多表明,通过敲除焦亡相关基因和促进凋亡可以抑制焦亡,并提高脓毒症体内及体外模型的生存率。其他一些关于自噬以及凋亡对脓毒症病程中脏器的保护作用的研究也说明了这点[32-33]。这可能与打断脓毒症瀑布式炎症反应链,终止了继发的免疫耗竭有关,这一结论尚需进一步试验证实。
5 结语焦亡作为一种保守的先天免疫环节,其在机体生长发育、应对刺激以及抵御外源微生物侵入方面的作用,仍然不甚明确。根据焦亡发生途径和机制的相关研究,发现其类似于自噬亦存在双向性作用。目前,脓毒症体内外模型试验提示,阻断焦亡对于脓毒症病程的进展利大于弊,但仍有以下几点科学问题有待进一步探究:⑴经历了对自噬由“致死”向“求存”的认识转变后,对于脓毒症中促自噬治疗的时机问题已得到基本认同。故在脓毒症中抑制焦亡治疗的时间问题,同样不容忽视,且结合焦亡与自噬的潜在关联性,该问题或许能够“一元论”处之。⑵焦亡相关蛋白如GSDM家族蛋白,多为进化保守性基因调控,这类基因通常在机体生长发育的诸多环节起到重要的生理作用,对这类蛋白表达的干预是否会有其他严重乃至致死性不良反应,其最终临床疗效究竟如何,有待进一步研究。⑶目前抑制焦亡试验中多采用基因敲除手段,该方法不适用于临床治疗,而多种自噬及凋亡相关的调节药物已用于临床试验,研究这些药物对焦亡是否有调控作用将有助于临床转化。
| [1] | Fink SL, Cookson BT. Apoptosis, pyroptosis, and necrosis: mechanistic description of dead and dying eukaryotic cells[J]. Infect Immun, 2005, 73(4): 1907-1916. DOI:10.1128/iai.73.4.1907-1916.2005 |
| [2] | 姚咏明, 张艳敏. 脓毒症发病机制最新认识[J]. 医学研究生学报, 2017, 30(7): 678-683. DOI:10.16571/j.cnki.1008-8199.2017.07.002 |
| [3] | Zychlinsky A, Prevost MC, Sansonetti PJ. Shigella flexneri induces apoptosis in infected macrophages[J]. Nature, 1992, 358(6382): 167-169. DOI:10.1038/358167a0 |
| [4] | Yuan JY, Najafov A, Py BF. Roles of caspases in necrotic cell death[J]. Cell, 2016, 167(7): 1693-1704. DOI:10.1016/j.cell.2016.11.047 |
| [5] | Broz P. Recognition of intracellular bacteria by inflammasomes[J]. Microbiol Spectr, 2019, 7(2). DOI:10.1128/microbiolspec.BAI-0003-2019 |
| [6] | Schroder K, Tschopp J. The inflammasomes[J]. Cell, 2010, 140(6): 821-832. DOI:10.1016/j.cell.2010.01.040 |
| [7] | 何岱昆, 邵义如, 周芳庆, 等. 核转录因子-KB参与光气吸入性肺损伤NLRP3炎症小体的表达[J]. 中华急诊医学杂志, 2018, 27(6): 624-630. DOI:10.3760/cma.j.issn.1671-0282.2018.06.012 |
| [8] | Jorgensen I, Rayamajhi M, Miao EA. Programmed cell death as a defence against infection[J]. Nat Rev Immunol, 2017, 17(3): 151-164. DOI:10.1038/nri.2016.147 |
| [9] | Shi JJ, Zhao Y, Wang K, et al. Cleavage of GSDMD by inflammatory caspases determines pyroptotic cell death[J]. Nature, 2015, 526(7575): 660-665. DOI:10.1038/nature15514 |
| [10] | Ding JJ, Shao F. SnapShot: The noncanonical inflammasome[J]. Cell, 2017, 168(3): 544-544.e1. DOI:10.1016/j.cell.2017.01.008 |
| [11] | Kayagaki N, Stowe IB, Lee BL, et al. Caspase-11 cleaves gasdermin D for non-canonical inflammasome signalling[J]. Nature, 2015, 526(7575): 666-671. DOI:10.1038/nature15541 |
| [12] | Lorey MB, Rossi K, Eklund KK, et al. Global characterization of protein secretion from human macrophages following non-canonical caspase-4/5 inflammasome activation[J]. Mol Cell Proteomics, 2017, 16(4 suppl 1): S187-199. DOI:10.1074/mcp.m116.064840 |
| [13] | Wang YP, Gao WQ, Shi XY, et al. Chemotherapy drugs induce pyroptosis through caspase-3 cleavage of a gasdermin[J]. Nature, 2017, 547(7661): 99-103. DOI:10.1038/nature22393 |
| [14] | Ding JJ, Wang K, Liu W, et al. Pore-forming activity and structural autoinhibition of the gasdermin family[J]. Nature, 2016, 535(7610): 111-116. DOI:10.1038/nature18590 |
| [15] | Tummers B, Green DR. Caspase-8: regulating life and death[J]. Immunol Rev, 2017, 277(1): 76-89. DOI:10.1111/imr.12541 |
| [16] | Wang Y, An R, Umanah GK, et al. A nuclease that mediates cell death induced by DNA damage and poly(ADP-ribose) polymerase-1[J]. Science, 2016, 354(6308): pii: aad6872. DOI:10.1126/science.aad6872 |
| [17] | Liu J, Livingston MJ, Dong GE, et al. Histone deacetylase inhibitors protect against cisplatin-induced acute kidney injury by activating autophagy in proximal tubular cells[J]. Cell Death Dis, 2018, 9(3): 322. DOI:10.1038/s41419-018-0374-7 |
| [18] | Shao AW, Wang Z, Wu HJ, et al. Enhancement of autophagy by histone deacetylase inhibitor trichostatin A ameliorates neuronal apoptosis after subarachnoid hemorrhage in rats[J]. Mol Neurobiol, 2016, 53(1): 18-27. DOI:10.1007/s12035-014-8986-0 |
| [19] | Abe J, Morrell C. Pyroptosis as a regulated form of necrosis: pi+/annexin v-/high caspase 1/low caspase 9 activity in cells pyroptosis?[J]. Circ Res, 2016, 118(10): 1457-1460. DOI:10.1161/CIRCRESAHA.116.308699 |
| [20] | Mao K, Klionsky DJ. Xenophagy: A battlefield between host and microbe, and a possible avenue for cancer treatment[J]. Autophagy, 2017, 13(2): 223-224. DOI:10.1080/15548627.2016.1267075 |
| [21] | Springer MZ, MacLeod KF. In Brief: Mitophagy: mechanisms and role in human disease[J]. J Pathol, 2016, 240(3): 253-255. DOI:10.1002/path.4774 |
| [22] | Ho TT, Warr MR, Adelman ER, et al. Autophagy maintains the metabolism and function of young and old stem cells[J]. Nature, 2017, 543(7644): 205-210. DOI:10.1038/nature21388 |
| [23] | Takahama M, Akira S, Saitoh T. Autophagy limits activation of the inflammasomes[J]. Immunol Rev, 2018, 281(1): 62-73. DOI:10.1111/imr.12613 |
| [24] | Stocks C J, Schembri M A, Sweet M J, et al. For when bacterial infections persist: Toll-like receptor-inducible direct antimicrobial pathways in macrophages[J]. J Leukoc Biol, 2018, 103(1): 35-51. DOI:10.1002/JLB.4RI0917-358R |
| [25] | Kim JY, Paton JC, Briles DE, et al. Streptococcus pneumoniae induces pyroptosis through the regulation of autophagy in murine microglia[J]. Oncotarget, 2015, 6(42): 44161-44178. DOI:10.18632/oncotarget.6592 |
| [26] | Pu QQ, Gan CP, Li RP, et al. Atg7 deficiency intensifies inflammasome activation and pyroptosis in pseudomonas sepsis[J]. J Immunol, 2017, 198(8): 3205-3213. DOI:10.4049/jimmunol.1601196 |
| [27] | Shankar-Hari M, Phillips GS, Levy ML, et al. Developing a new definition and assessing new clinical criteria for septic shock: for the third international consensus definitions for sepsis and septic shock (Sepsis-3)[J]. JAMA, 2016, 315(8): 775-787. DOI:10.1001/jama.2016.0289 |
| [28] | Seymour CW, Liu VX, Iwashyna TJ, et al. Assessment of clinical criteria for sepsis: for the third international consensus definitions for sepsis and septic shock (Sepsis-3)[J]. JAMA, 2016, 315(8): 762-774. DOI:10.1001/jama.2016.0288 |
| [29] | Rhodes A, Evans LE, Alhazzani W, et al. Surviving sepsis campaign: international guidelines for management of sepsis and septic shock: 2016[J]. Intensive Care Med, 2017, 43(3): 304-377. DOI:10.1007/s00134-017-4683-6 |
| [30] | Ho J, Yu J, Wong SH, et al. Autophagy in sepsis: Degradation into exhaustion?[J]. Autophagy, 2016, 12(7): 1073-1082. DOI:10.1080/15548627.2016.1179410 |
| [31] | Song F, Hou JC, Chen ZC, et al. Sphingosine-1-phosphate receptor 2 signaling promotes caspase-11–dependent macrophage pyroptosis and worsens escherichia coli sepsis outcome[J]. Anesthesiology, 2018, 129(2): 311-320. DOI:10.1097/aln.0000000000002196 |
| [32] | 葛赟, 黄曼, 马岳峰. 自噬在脓毒症发生发展中作用的研究进展[J]. 中华急诊医学杂志, 2017, 26(11): 1330-1333. DOI:10.3760/cma.j.issn.1671-0282.2017.11.022 |
| [33] | 吴田田, 姚咏明. 提高脓毒症中自噬对重要脏器保护效应的认识[J]. 中华急诊医学杂志, 2017, 26(2): 135-138. DOI:10.3760/cma.j.issn.1671-0282.2017.02.001 |
 2019, Vol. 28
2019, Vol. 28




