输液是颅脑创伤、严重脑出血和脑梗死等神经重症患者急性和亚急性期必不可少的治疗。液体容量的状态是决定脑灌注和氧合的主要决定因素之一,而且神经重症患者可能需要渗透性治疗控制颅内压,严重的意识障碍患者感染发生率高,更加重了液体管理的复杂性。如果液体容量不足,将导致脏器灌注不足,尤其是脑灌注不足,容易导致并加重继发性脑缺血,导致预后不良;而过量的液体治疗将造成心肺功能更大的负荷,容易导致并加重心功能不全和肺渗出,并加重感染,导致严重的并发症。目前随着我国经济社会的发展,尤其是中心城市老龄化的进展,老年神经重症的患者也越来越多,而老年患者的心肺功能储备差,免疫力抵抗力差,脑血管硬化,诊治过程中更易并发心肺功能不全和继发性脑缺血;老年患者的感染率也更高;使得病情和液体管理变得更加复杂。重视液体管理策略,朝精准液体管理方向努力对于神经重症患者的治疗中显得尤其重要。
1 人体的有效血容量和体液分布液体的体质量约占人体总体质量的60%,液体体重占比随着年龄的增长而下降;婴幼儿可以高达80%,而老年人可以下降至50%左右。在60%体重占比中,细胞内液占40%,细胞外液20%;而细胞外液中,组织间隙液体占15%,而血容量占5%。这说明在正常生理状态下,血容量在人体液体总量中仅占1/12。组织间隙液体量约为正常血容量的3倍,这决定了体液体内分布的异常将严重影响全身系统有效血容量。
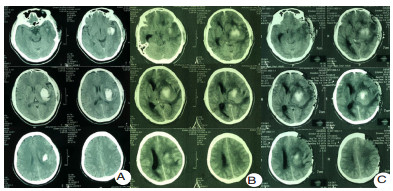
在严重脑损伤的病理生理状态下,尤其是严重的水盐电解质紊乱或感染炎症的状态下,液体的分布将极大的改变全身系统有效血容量,也将影响脑血流灌注而导致影响脑功能。对于神经危重症患者,包括急性中重度颅脑损伤和严重脑卒中患者,急性期需要甘露醇、甘油果糖等脱水渗透性治疗控制颅内压;存在不同程度的感染和全身炎症反应综合征,尤其是严重脓毒血症时,输入的部分液体通过毛细血管的组织间隙渗漏,液体存在异常分布,炎症的严重程度与体液异常分布的程度显著相关。高热、气管切开、呼吸机的使用、植物神经功能紊乱时的交感过兴奋发作等也将导致体液通过呼吸道和体表大量隐性丢失。这些液体异常的分布和丢失目前无法做到精准的测量,显著增加液体精准管理的困难和可能影响患者的预后。临床上,目前在国内神经重症管理中更多倾向于限制液体的策略,以减少肺水肿和心功能不全等并发症,但在缺乏严格有效血容量的监测下,可能导致严重的继发脑血缺血并发症(图 1)。该例左侧基底节脑出血患者入院时神志清楚,经过12 d的保守治疗后,在没有血肿扩大的情况下,因为过度液体负平衡导致的严重继发脑缺血后形成脑疝而需要开颅去骨瓣减压。
|
| A:第1天,神志清楚遵嘱;B:第23天,脑疝;C:第23天,开颅左侧去骨瓣术后,脑缺血进一步加重 图 1 患者高血压自发性脑出血CT结果 |
|
|
对于颅脑创伤等神经重症患者,通过包括渗透性治疗的综合治疗控制颅内压于20 mmHg (1 mmHg=0.133 kPa)以下,维持平均动脉压在60~70 mmHg水平被认为是理想的,而液体复苏是维持脑灌注压的基础,并预防因为低血压导致的继发性脑损害。在理想的颅内压、平均动脉压和脑灌注压情况下,脑血流灌注、脑微循环和脑氧供是否就是最佳的状态呢?这与全身的系统有效血容量以及脑血管的状态也必然相关。维持正常的有效系统血容量只是保持脑组织良好灌注和氧供的基础。
临床上普遍存在担心积极输液可能导致神经重症患者的颅内压升高,Fletcher等[1]在回顾性队列研究中发现,积极输液和限制性输液在顽固性高颅压的发生率上并没有显著差别。在血脑屏障并没有完全广泛破坏的情况下,渗透压梯度是影响脑水肿的关键因素,而非输液量;所以如果患者存在需要颅内压控制的情况下,需要严格监测血浆渗透压和颅内压,并控制在合理的目标值;只有渗透压梯度和颅内压达到合理目标的渗透性治疗才可能是最合适的。对于老年患者、肾功能存在易损因素、脑水肿不严重、颅内压容易控制的情况下,建议渗透压维持在290~300 mosm/L;对于年轻患者,颅内压控制压力大、脑水肿严重的患者,建议血浆渗透压控制在300~320 mosm/L。当然最大限度的液体平衡将显著增加双肺的渗出导致肺水肿。Pelz等[2]对39例大面积脑梗患者的回顾性研究认为限制性输液组预后更好,预后良好组比不良组的累计液体平衡量要低,但预后良好组与不良组相比,平均年龄少10岁[(55.1±12)岁vs (65.5±10.5)岁],使用更多的镇痛镇静和渗透性治疗药物;预后不良组对良好组的脓毒血症比例是94.7% vs 85%, 急性肾损伤(AKI)比例是15.8% vs 0;系统溶栓的比例是36.8% vs 50%, 机械取栓的比例是26.3% vs 60%, 虽然这些差异都无统计学意义,但两组分别只有20例和19例的样本量(太少),不能说明这些因素没有影响。而实际临床上年龄、感染和脏器功能不全的严重程度可能在很大程度上影响患者的预后。而且该研究发现预后不良组并没有液体过度负荷如肺和周围组织水肿的表现,这更说明患者的预后不良并不是因为没有限制性输液。
神经重症脑损伤患者,在原发脑损害情况下,出现继发性脑缺血、脑水肿加重、肺水肿和感染并发症等都将导致脑损害进一步加重。毫无疑问,任何导致影响脑微循环、脑血供和脑氧供不良的因素都将进一步加重脑损伤,包括液体管理的不合理方案。如果限制性输液导致全身系统有效不容量不足,甚至血压需要去甲肾上腺素去维持的方案坚决应该摒弃。临床上很多临床医生认为血压不稳是因为循环中枢的衰竭,这些患者中部分患者可能可以通过合理的液体管理稳定血压而不需要去甲肾上腺素维持;如在深度镇痛镇静的情况下,心率100~120次/min以上并排除体温等其他应激因素的情况下,应该考虑评估排除有效血容量不足的可能。
如何避免过度输液加重肺渗出水肿、全身组织水肿和感染等不良反应,同时又能避免输液不足导致加重继发性的脑缺血,精准的有效血容量评估和识别相关的影响因素尤为重要。
3 神经重症患者全身系统有效血容量的影响因素和精准评估心率、血压和尿量是简单地反映血容量的指标,但目前临床上没有确切的单一的指标来准确评估有效血容量的状态。中心静脉压(CVP)并不是理想的血容量和液体反应性指标。动脉脉压变异度(PPV)被认为是更为有前景的血容量和液体反应性指标,在PPV和CVP指导下的限制性液体管理方案与基于体重的液体管理相比,明显减少低氧血症的发作。PiCCO可以监测肺水指数,研究表明PiCCO系统衍生的整体舒张末期指数(GEDI)和心输出量(CO)可预测SAH患者的肺水肿和心力衰竭;基于CO的液体管理策略可能改善SAH相关迟发性脑缺血(DCI)的神经预后[3]。血液稀释法可以用来测量全身总体血容量[4]。对于颅脑创伤之外的创伤患者的前瞻性随机对照研究发现,肺动脉导管连续心输出量以及BNP的监测可能是反映心脏前负荷增加的有用指标,但BNP和右心室舒张末期容积指数(RVEDVI)与血管内容积状态无关[5]。
临床上必须将所有容量可能相关的指标综合来评估全身系统有效血容量。除了心率、血压和尿量外,影响液体治疗需要参考的指标有:24 h出入液量、出汗和呼吸道等隐形液体丢失的量、呼吸机肺顺应性指标、PiCCO肺水含量、中心静脉压、下肢血管的变异度、反映炎症严重程度的指标包括C反应蛋白(CRP)、降钙素原体(PCT)、血白细胞和中性粒比、血乳酸、体温等。其中,炎症的严重程度决定了组织毛细血管的通透性增加导致液体渗出到组织间隙的严重程度,是影响液体体内的再分布最重要因素,影响全身系统有效血容量,严重时在没有及时调整合理输液的情况下,容易加重继发脑缺血性损害。综合多模态各项指标在治疗动态中评估容量,并多模态监测脑相关参数,如颅压、脑灌注压、脑血流和脑氧等,并及时细致调整治疗策略,致力于液体管理目标—个体化最佳合适液体容量,不过负荷导致肺水肿和心功能不全,也不因为容量不足加重神经重症患者的继发脑缺损损害。
4 脑保护精准液体管理的研究方向基于脑自动调节指数的个体化治疗有望指导TBI患者的治疗。当动脉血压(ABP)改变与颅内压(ICP)的反相关改变相关时,就可以推断出功能性自动调节,这意味着血流减少,从而导致脑血容量减少。ABP和ICP之间的相关系数是压力反应性指数(PRx):正值表示对ABP的被动反应,与自动调节丧失相关,而负值表示完好的自动调节。脑灌注压(CPP)优化策略利用PRx和CPP之间的U形关系,其中最小PRx表示最优CPP(CPPopt)。前瞻性分析表明与目前提出的将CPP维持在60~70 mmHg的建议相比,CPPopt可能是TBI良好神经预后更好的预测因子[6]。神经重症患者如何精准液体管理实现CPPopt并探讨预后是未来值得研究的方向。随着临床上可以监测越来越多病理生理参数指标,期待最终会从静态治疗转向个体化动态精准液体治疗,最终实现最佳脑保护和预后。
| [1] | Fletcher JJ, Bergman K, Blostein PA, et al. Fluid balance, complications, and brain tissue oxygen tension monitoring following severe traumatic brain injury[J]. Neurocritical Care, 2010, 13(1): 47-56. DOI:10.1007/s12028-010-9345-2 |
| [2] | Pelz JO, Fischer MM, Bungert-Kahl P, et al. Fluid balance variations during the early phase of large hemispheric stroke are associated with patients' functional outcome[J]. Front Neurol, 2019, 10: 720. DOI:10.3389/fneur.2019.00720 |
| [3] | Obata Y, Takeda J, Sato Y, et al. A multicenter prospective cohort study of volume management after subarachnoid hemorrhage: circulatory characteristics of pulmonary edema after subarachnoid hemorrhage[J]. J Neurosurg, 2016, 125(2): 254-263. DOI:10.3171/2015.6.JNS1519 |
| [4] | Hilberath JN, Thomas ME, Smith T, et al. Blood volume measurement by hemodilution: association with valve disease and re-evaluation of the Allen Formula[J]. Perfusion, 2015, 30(4): 305-311. DOI:10.1177/0267659114547250 |
| [5] | Takahashi EA, Moran SE, Hayashi MS, et al. Brain-type natriuretic peptide and right ventricular end-diastolic volume index measurements are imprecise estimates of circulating blood volume in critically ill subjects[J]. J Trauma Acute Care Surg, 2013, 75(5): 813-818. DOI:10.1097/TA.0b013e3182a85f3a |
| [6] | Donnelly J, Czosnyka M, Adams H, et al. Pressure reactivity-based optimal cerebral perfusion pressure in a traumatic brain injury cohort[J]. Acta Neurochir Suppl, 2018, 126: 209-212. DOI:10.1007/978-3-319-65798-1_43 |
 2019, Vol. 28
2019, Vol. 28


