2 福建医科大学省立临床医学院,福建省立医院神经内科 350001
原发性中枢神经系统疾病导致的应激性心肌病被称为神经源性心肌病(neurogenic stunned myocardium, NSM),是在神经系统事件后发生的急性可逆性心肌功能障碍[1-3]。NSM与许多神经系统疾病如动脉瘤性蛛网膜下腔出血(aneurysmal subarachnoid hemorrhage, aSAH)、脑出血、脑梗死等相关[1-2, 4],可使神经系统预后恶化[7-10]。本研究旨在综合分析重症aSAH患者发生NSM的潜在危险因素,以期早期识别高危患者,及时合理治疗,改善临床结局。
1 资料与方法 1.1 一般资料回顾性纳入2017年1月至2019年12月收治福建省立医院神经内科的aSAH患者58例。入选标准:①年龄 > 18岁;②发病24 h以内;③头颅CT提示蛛网膜下腔高密度影,并经数字减影血管造影(DSA)明确颅内动脉瘤;④入院评估Hunt-Hess分级3~5分;⑤患者及家属签署知情同意书。排除标准:①非动脉瘤性SAH;②未行超声心动图检查;③既往患心肌炎、心肌病、慢性心力衰竭;④既往超声心动图提示室壁运动异常或左室射血分数降低;⑤行外科开颅动脉瘤夹闭术。研究经福建省立医院医学伦理委员会批准(K2016-12-019)。
1.2 基本情况记录患者的性别、年龄、卒中危险因素、动脉瘤位置和并发症,评估入院SAH相关分级评分。入院后连续3 d检测血清肌钙蛋白I(cTnI)、N末端B型利钠肽原(NT-proBNP)水平并记录其最高值(cTnI > 0.1 ng/mL定义为增高;NT-proBNP < 50岁正常值< 450 pg/mL,50~75岁正常值< 900Pg/mL,> 75岁正常值< 1 800 pg/mL,超过以上标准定义为增高);检测超敏C反应蛋白(hsCRP)、同型半胱氨酸(Hcy)、空腹血糖(GLU)、低密度脂蛋白胆固醇(LDL-C)。心电图异常定义为:至少2个导联出现以下6条中的1条或以上:QTc延长、T波倒置、ST段抬高(≥0.1 mV)、ST段压低(≥0.1 mV)、异常Q波或QS波、窦性心动过速或心动过缓[11]。入院48 h内完成首次超声心动图检查,并择日复查以证实室壁运动异常是否改善。NSM定义为:(1)超声心动图见短暂性左心室功能障碍,表现为心尖气球状扩张,或心室中部、基底部,或局灶性室壁运动异常;可存在右心室受累;可以存在各类型之间的转变;区域性室壁运动异常通常不仅限于单个心外膜血管分布范围;(2)新的心电图异常或心肌肌钙蛋白适度升高[2, 12-13]。
1.3 治疗方法所有患者予甘露醇脱水减轻脑水肿、尼莫地平防止脑血管痉挛等常规内科治疗,并行动脉瘤血管内治疗。
1.4 预后评价采用改良Rankin量表(Modified Rankin Scale, mRS)评估发病90 d转归,预后不良定义为mRS > 2分。
1.5 统计学方法采用SPSS 22.0对数据进行统计分析,计数资料组间比较采用χ2检验;计量资料符合正态分布,组间比较采用方差分析;不符合正态分布,组间比较采用非参数Mann-Whitney U检验;采用多因素Logistic回归分析发生NSM的危险因素。采用受试者工作特征曲线(ROC)评价危险因素对重症aSAH并发NSM的预测价值。以P < 0.05定义为差异有统计学意义。
2 结果 2.1 NSM组和非NSM组相关因素比较58例重症aSAH患者中NSM组24例(41.38%),女16例,年龄(59.5±14.85)岁;非NSM组34例(58.62%),女12例,年龄(59.09±12.89)岁。与非NSM组比较,NSM组的Hunt-Hess分级、Fisher分级更高,GCS评分更低,血cTnI、NT-proBNP、hsCRP、空腹GLU、LDL-C水平高,差异有统计学意义(P < 0.05)。NSM组37.5%并发脑梗死高于非NSM组的11.76%(P=0.021),100%出现心电图异常高于非NSM组的47.06%(P < 0.001),90 d预后不良发生率83.33%高于非NSM组的38.24%(P=0.001), 差异有统计学意义(表 1)。
| 指标 | NSM组(n=24) | 非NSM组(n=34) | χ2值或t值 | P值 |
| 性别,女性(n,%) | 16(66.67) | 22(64.71) | 0.024 | 0.877 |
| 年龄(岁,均数±标准差) | 59.5±14.85 | 59.09±12.89 | -0.112 | 0.911 |
| 基础疾病及个人史(n,%) | ||||
| 高血压 | 13(54.17) | 12(35.29) | 2.043 | 0.153 |
| 冠心病 | 1(4.17) | 2(5.88) | 0.132 | 0.717 |
| 糖尿病 | 2(8.33) | 2(5.88) | 0.084 | 0.771 |
| 脑梗死 | 0(0) | 1(2.94) | 1.0 | |
| 吸烟 | 6(25) | 9(26.47) | 0.016 | 0.9 |
| 饮酒 | 7(29.17) | 8(23.53) | 0.233 | 0.629 |
| 临床分级评分(n,%) | ||||
| H-H 3分 | 6(25) | 17(50) | 9.216 | 0.01 |
| H-H 4分 | 8(33.33) | 14(41.18) | ||
| H-H 5分 | 10(41.67) | 3(8.82) | ||
| GCS 3~12分 | 18(75) | 14(41.18) | 6.508 | 0.011 |
| Fish 3~4分 | 23(95.83) | 18(52.94) | 12.492 | < 0.001 |
| 动脉瘤位置 | ||||
| 后循环(n,%) | 5(20.83) | 3(8.82) | 1.707 | 0.191 |
| 发病至急诊时间(h) | 7.73±9.23 | 8.62±5.19 | 0.467 | 0.642 |
| 发病至介入治疗时间(h) | 10.88±9.79 | 11.87±5.75 | 0.485 | 0.629 |
| 并发症(n,%) | ||||
| 脑梗死 | 9(37.5) | 4(11.76) | 5.358 | 0.021 |
| 脑积水 | 7(29.17) | 7(20.59) | 0.565 | 0.452 |
| 癫痫 | 6(25) | 6(17.65) | 0.464 | 0.496 |
| 血液指标 | ||||
| cTnI(ng/mL) | 1.78(0.27, 6.07) | 0(0, 0.09) | -5.827a | < 0.001 |
| cTnI增高(n,%) | 22(91.67) | 8(23.53) | 26.158 | < 0.001 |
| NT-proBNP(Pg/mL) | 3464.5(1335.0, 6616.0) | 171.9(62.94, 388.35) | -5.763a | < 0.001 |
| NT-proBNP增高(n,%) | 21(87.5) | 3(8.82) | 35.902 | < 0.001 |
| hsCRP(mg/l) | 59.34±74.43 | 16.48±24.46 | -2.719 | 0.011 |
| Hcy(μmol/l) | 9.74±2.92 | 10.07±4.63 | 0.309 | 0.759 |
| 空腹GLU(mmol/l) | 8.39±3.32 | 6.65±2.06 | -2.460 | 0.017 |
| LDL-C(mmol/l) | 2.14±0.85 | 2.64±0.74 | 2.378 | 0.021 |
| 心电图异常(n,%) | 24(100) | 16(47.06) | < 0.001 | |
| 临床转归(n,%) | ||||
| 90 d mRS > 2分 | 20(83.33) | 13(38.24) | 11.668 | 0.001 |
| 注:a为Z值 | ||||
二分类logistic回归结果显示,在校正了其他因素的影响后,cTnI水平增高(OR=34.038, 95% CI:2.949~392.853, P=0.005)、NT-proBNP水平增高(OR=69.335, 95%CI: 6.980~688.777, P=0.000)与NSM的发生显著相关,可独立预测重症aSAH后NSM的发生(表 2)。
| 变量 | 回归系数 | 标准误差 | Wald | P值 | OR(95%CI) |
| cTnI | 3.527 | 1.248 | 7.989 | 0.005 | 34.038(2.949~392.853) |
| NT-proBNP | 4.239 | 1.171 | 13.094 | 0.000 | 69.335(6.980~688.777) |
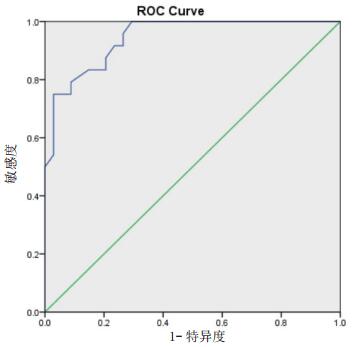
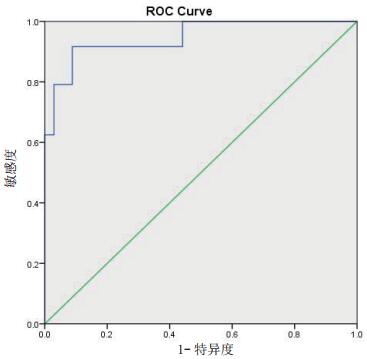
cTnI水平ROC曲线下面积为0.944(95%CI: 0.892~0.997, P < 0.001),当cTnI水平为0.305 ng/mL时,获得最大Youden指数0.721(敏感度75.0%、特异度97.1%)(图 1)。NT-proBNP水平ROC曲线下面积为0.947(95%CI:0.891~1.000, P < 0.001),当NT-proBNP水平为768.5 pg/mL时,获得最大Youden指数0.828(敏感度91.7%、特异度91.2%)(图 2)。
|
| 图 1 cTnI水平预测aSAH并发NSM的受试者工作特征曲线 |
|
|
|
| 图 2 NT-proBNP水平预测aSAH并发NSM的受试者工作特征曲线 |
|
|
NSM是与aSAH相关的常见并发症,一项前瞻性队列研究发现17%aSAH并发NCM[5-6]。机制通常归因于急性脑损伤引发的儿茶酚胺过量[1, 3, 14-17],导致心外膜冠状动脉痉挛,急性冠状动脉微循环功能障碍并引发心内膜下心肌缺血,亦可直接介导心肌损伤。NSM在SAH最初的48 h内发生率最高[19],故本研究选择在患者入院后48 h内完成超声心动图检查,发现41.38%的重症aSAH患者出现NSM。
既往研究发现SAH引起的神经系统损伤严重程度是NSM发生的重要预测指标。高Hunt-Hess分级与NSM密切相关[5, 7, 18],Kilbourn等[5]发现Fisher等级3或4与NCM的发展有关。本研究发现合并NSM的aSAH患者有更高的Hunt-Hess及Fisher评分,更低的GCS评分,提示NSM与aSAH临床严重程度相关,重症aSAH患者并发NSM的风险更高。
SAH早期即可出现心脏损害征象,表现cTn和NT-proBNP水平增高[19-20],有研究表明与超声心动图所见的室壁运动异常和射血分数降低明确相关[21-23]。Oras等[24]报道在SAH后48 h内获得的峰值hsTnT和NTproBNP是极好的阴性预测指标,适合筛查SAH患者是否合并NSM。cTnI、cTnT均可作为心肌损伤的诊断指标,cTnI在SAH后24~36 h内达峰值[25];NTproBNP是心力衰竭的诊断和预后指标[26],在症状发作后2~4 d达到峰值[24]。故本研究连续检测aSAH患者入院后3 d内的cTnI和NT-proBNP水平并记录其最高值,发现并发NSM的重症aSAH患者出现cTnI和NT-proBNP增高的比例分别为91.67%和87.5%,在控制了其他因素的干扰后, cTnI和NT-proBNP的增高可独立预测重症aSAH后NSM的发生,与Kilbourn等[5]的研究结果一致。
本研究中重症aSAH合并NSM患者的心电图异常发生率100%明显高于非NSM患者的47.06%。Kerro等[17]报道SAH后并发NSM患者的心电图异常发生率为59%~100%。aSAH后儿茶酚胺的激增导致心脏自主神经调节异常,同时直接损伤心肌累及心脏传导系统,并且颅内压增高、治疗性干预等因素,均可出现心电图异常[1, 6]。
虽然NSM预后良好,总体恢复率为66%~78%,且通常在2周内恢复[27-28],但SAH并发NSM的患者预后较差。一项包括36项研究,涉及3 917例患者的荟萃分析发现,NSM与迟发性脑缺血风险增加、不良结局、死亡相关[20]。本研究发现并发NSM的重症aSAH患者并发脑梗死的发生率为37.5%,高于非NSM患者的11.76%,90 d预后不良发生率83.33%亦高于非NSM患者的38.24%,与先前的研究结果相似[5]。考虑可能由于NSM继发的心输出量及血压的下降,加剧了aSAH后脑血管痉挛所致的脑缺血,心功能障碍同时也导致患者发生肺水肿和心律失常等全身性并发症的风险增加,造成预后不良[5]。
综上,重症aSAH患者并发NSM的病情更危重,预后转归较差,检测cTnI和NT-proBNP水平有助于早期发现并发NCM的患者,进一步结合超声心动图和心电图检测,明确NSM的存在,有利于及时予以干预,改善临床结局。
利益冲突 所有作者均声明不存在利益冲突。
| [1] | Murthy SB, Shah S, Rao CP, et al. Neurogenic Stunned Myocardium Following Acute Subarachnoid Hemorrhage: Pathophysiology and Practical Considerations[J]. J Intensive Care Med, 2015, 30(6): 318-325. DOI:10.1177/0885066613511054 |
| [2] | Kenigsberg BB, Barnett CF, Mai JC, Chang JJ. Neurogenic Stunned Myocardium in Severe Neurological Injury[J]. Curr Neurol Neurosci Rep, 2019, 19(11): 90. DOI:10.1007/s11910-019-0999-7 |
| [3] | Mierzewska-Schmidt M, Gawecka A. Neurogenic stunned myocardium - do we consider this diagnosis in patients with acute central nervous system injury and acute heart failure?[J]. Anaesthesiol Intensive Ther, 2015, 47(2): 175-180. DOI:10.5603/AIT.2015.0017 |
| [4] | 宋剑平, 孔雪, 封秀琴, 等. 急性脑卒中患者颈动脉狭窄与脑心综合征风险的队列研究[J]. 中华急诊医学杂志, 28(8): 1034-1036. DOI:10.3760/cma.j.issn.1671-0282.2019.08.021 |
| [5] | Kilbourn KJ, Ching G, Silverman DI, et al. Clinical outcomes after neurogenic stress induced cardiomyopathy in aneurysmal sub-arachnoid hemorrhage: a prospective cohort study[J]. Clin Neurol Neurosurg, 2015, 128: 4-9. DOI:10.1016/j.clineuro.2014.10.017 |
| [6] | Aronow WS. Neurogenic stress cardiomyopathy associated with subarachnoid hemorrhage[J]. Futur Cardiol, 2015, 11(1): 77-87. DOI:10.2217/fca.14.73 |
| [7] | Kilbourn KJ, Levy S, Staff I, et al. Clinical characteristics and outcomes of neurogenic stress cadiomyopathy in aneurysmal subarachnoid hemorrhage[J]. Clin Neurol Neurosurg, 2013, 115(7): 909-914. DOI:10.1016/j.clineuro.2012.09.006 |
| [8] | Okabe T, Kanzaria M, Rincon F, et al. Cardiovascular protection to improve clinical outcomes after subarachnoid hemorrhage: is there a proven role?[J]. Neurocrit Care, 2013, 18(2): 271-284. DOI:10.1007/s12028-012-9804-z |
| [9] | van der Bilt I, Hasan D, van den Brink R, et al. Cardiac dysfunction after aneurysmal subarachnoid hemorrhage: Relationship with outcome[J]. Neurology, 2014, 82(4): 351-358. DOI:10.1212/wnl.0000000000000057 |
| [10] | Kilbourn KJ, Levy S, Staff I, et al. Clinical characteristics and outcomes of neurogenic stress cardiomyopathy in aneurysmal subarachnoid hemorrhage[J]. Clin Neurol Neurosurg, 2013, 115(7): 909-914. DOI:10.1016/j.clineuro.2012.09.006 |
| [11] | Baydin A, Amanvermez R, Tuncel ÖK, et al. Ischemia-modified albumin is not better than creatine kinase-MB and cardiac troponin I in predicting a cardiac injury in nontraumatic subarachnoid hemorrhage[J]. Am J Emerg Med, 2015, 33(4): 488-492. DOI:10.1016/j.ajem.2014.10.007 |
| [12] | Ghadri JR, Wittstein IS, Prasad A, et al. International expert consensus document on takotsubo syndrome (part I): clinical characteristics, diagnostic criteria, and pathophysiology[J]. Eur Heart J, 2018, 39(22): 2032-2046. DOI:10.1093/eurheartj/ehy076 |
| [13] | Prasad A, Lerman A, Rihal CS. Apical ballooning syndrome (Tako-Tsubo or stress cardiomyopathy): a mimic of acute myocardial infarction[J]. Am Heart J, 2008, 155(3): 408-417. DOI:10.1016/j.ahj.2007.11.008 |
| [14] | Chen Z, Venkat P, Seyfried D, et al. Brain-heart interaction: cardiac complications after stroke[J]. Circ Res, 2017, 121(4): 451-468. DOI:10.1161/CIRCRESAHA.117.311170 |
| [15] | Dande AS, Pandit AS. Broken heart syndrome, neurogenic stunned myocardium and stroke[J]. Curr Treat Options Cardio Med, 2013, 15(3): 265-275. DOI:10.1007/s11936-013-0235-8 |
| [16] | Kenigsberg BB, Barnett CF, Mai JC, et al. Neurogenic stunned myocardium in severe neurological injury[J]. Curr Neurol Neurosci Rep, 2019, 19(11): 90. DOI:10.1007/s11910-019-0999-7 |
| [17] | Kerro A, Woods T, Chang JJ. Neurogenic stunned myocardium in subarachnoid hemorrhage[J]. J Crit Care, 2017, 38: 27-34. DOI:10.1016/j.jcrc.2016.10.010 |
| [18] | Malik AN, Gross BA, Rosalind Lai PM, et al. Neurogenic Stress Cardiomyopathy After Aneurysmal Subarachnoid Hemorrhage[J]. World Neurosurg, 2015, 83(6): 880-885. DOI:10.1016/j.wneu.2015.01.013 |
| [19] | Zhang LM, Wang ZL, Qi SH. Cardiac troponin elevation and outcome after subarachnoid hemorrhage: a systematic review and meta-analysis[J]. J Stroke Cerebrovasc Dis, 2015, 24(10): 2375-2384. DOI:10.1016/j.jstrokecerebrovasdis.2015.06.030 |
| [20] | Zhang LM, Zhang B, Qi SH. Impact of echocardiographic wall motion abnormality and cardiac biomarker elevation on outcome after subarachnoid hemorrhage: a meta-analysis[J]. Neurosurg Rev, 2020, 43(1): 59-68. DOI:10.1007/s10143-018-0985-6 |
| [21] | Tanabe M, Crago EA, Suffoletto MS, et al. Relation of elevation in cardiac troponin I to clinical severity, cardiac dysfunction, and pulmonary congestion in patients with subarachnoid hemorrhage[J]. Am J Cardiol, 2008, 102(11): 1545-1550. DOI:10.1016/j.amjcard.2008.07.053 |
| [22] | Hravnak M, Frangiskakis JM, Crago EA, et al. Elevated cardiac troponin I and relationship to persistence of electrocardiographic and echocardiographic abnormalities after aneurysmal subarachnoid hemorrhage[J]. Stroke, 2009, 40(11): 3478-3484. DOI:10.1161/strokeaha.109.556753 |
| [23] | Tanabe M, Crago EA, Suffoletto MS, et al. Relation of elevation in cardiac troponin I to clinical severity, cardiac dysfunction, and pulmonary congestion in patients with subarachnoid hemorrhage[J]. Am J Cardiol, 2008, 102(11): 1545-1550. DOI:10.1016/j.amjcard.2008.07.053 |
| [24] | Oras J, Grivans C, Dalla K, et al. High-sensitive troponin T and N-terminal pro B-type natriuretic peptide for early detection of stress-induced cardiomyopathy in patients with subarachnoid hemorrhage[J]. Neurocrit Care, 2015, 23(2): 233-242. DOI:10.1007/s12028-015-0108-y |
| [25] | Bruder N, Rabinstein A. Participants in the International Multi-Disciplinary Consensus Conference on the Critical Care Management of Subarachnoid Hemorrhage. Cardiovascular and pulmonary complications of aneurysmal subarachnoid hemorrhage[J]. Neurocrit Care, 2011, 15(2): 257-269. DOI:10.1007/s12028-011-9598-4 |
| [26] | 沈林霞, 郑亚安, 田兆兴. N末端脑钠肽前体对脓毒症休克患者左心室舒张功能障碍的预测价值[J]. 中华急诊医学杂志, 2018, 27(2): 164-167. DOI:10.3760/cma.j.issn.1671-0282.2018.02.011 |
| [27] | Banki N, Kopelnik A, Tung P, et al. Prospective analysis of prevalence, distribution, and rate of recovery of left ventricular systolic dysfunction in patients with subarachnoid hemorrhage[J]. J Neurosurg, 2006, 105(1): 15-20. DOI:10.3171/jns.2006.105.1.15 |
| [28] | Jyotsna M, Prasad V, Indrani G, et al. Importance of detection of segmental wall motion abnormalities of left ventricle in nontraumatic subarachnoid hemorrhage: a prospective study[J]. Echocardiography, 2010, 27(5): 496-500. DOI:10.1111/j.1540-8175.2009.01080.x |
 2020, Vol. 29
2020, Vol. 29




