2 浙江大学医学院附属儿童医院心脏中心,杭州 310052;
3 浙江大学医学院附属儿童医院心脏外科,杭州 310052;
4 浙江大学医学院附属儿童医院心脏中心,杭州 310052
腺病毒(adenovirus,ADV)是导致小儿肺炎及重症肺炎的主要致病菌之一。一些人群如婴幼儿或免疫缺陷患者,可能发生严重呼吸衰竭(ARDS)和多器官功能障碍综合征(MODS),危及生命,病死率超过50%,存活者有14%~60%遗留有难以逆转的肺部后遗症[1-2]。2019年腺病毒在南方呈流行趋势,重症以3型和7型多见,HAdV-7B型是2019年中国南方发病地区主要流行株[3-4]。此类腺病毒重症肺炎是儿科ICU的救治难点,往往需要应用高频振荡呼吸机(HFO)、连续性肾脏替代治疗(CRRT),甚至体外膜费氧合(ECMO)支持治疗。由于国内ECMO起步较晚,目前在国内小儿领域,ECMO辅助治疗重症腺病毒相关报道少见。据国际体外生命支持组织数据,ECMO支持的重症腺病毒肺炎,肺损伤严重,可合并多器官损伤,治疗难度大,支持时间长,存活率仅为38%[5]。因此,本文回顾总结了本中心2018年1月至2019年9月的重症腺病毒ECMO支持病例,为重症腺病毒ECMO救治提供临床资料,以进一步提高重症腺病毒ECMO救治的生存率。
1 资料与方法 1.1 一般资料本组9例患儿,男4例,女5例;年龄6个月~5岁,年龄(2.7±1.6)岁,体质量(11.8±2.9)kg,均有不同程度的营养不良,例7存在重度营养不良。纳入标准:经病原学检测,包括免疫胶体金法、病毒抗体或DNA检测等证实为腺病毒感染。ECMO适应证:①OI > 40持续6 h以上或PaO2/FiO2 < 50 mmHg持续3h以上;②Murray评分 > 3;③高通气支持下(PIP > 40 cmH2O), 仍有高碳酸血症酸中毒(pH < 7.0);④机械通气并发气漏综合征常规处理无效[6-7]。所有患者均签署知情同意书并通过医院伦理委员会审查。
其中,1例存在基础疾病(例9):先天性食道闭锁术后,支气管狭窄,明确诊断后ECMO下行双侧支气管slide手术。合并其他病原体感染4例,合并ARDS 4例,气漏综合征2例,感染性多脏器功能衰竭2例,脓毒性休克2例,急性肾功能衰竭1例(联合CRRT治疗),中毒性脑病3例,急性肝损4例,胰腺炎1例,三系血细胞减少2例,白细胞减少症3例。重症腺病毒肺炎ECMO支持的临床特点及转归见表 1。其中,例4、6、8、9ECMO前需高频呼吸机支持,其余为常频呼吸机支持。氧合指数(OI):40±15,PaO2/FiO2:47±12,ECMO前呼吸机支持时间为25 h(14 h, 69 h)。ECMO前呼吸机参数见表 2。
| 病例 | 次要诊断 | 年龄 | 体质量(kg) | 合并感染 | ECMO前MV时间(h) | ECMO转流时间(d) | 呼吸机时间(d) | ICU住院时间(d) | 总住院时间(d) | 并发症 | 转归 |
| 1 | 脓毒症休克,高乳酸血症,中毒性脑病,急性肝损,白细胞减少症 | 1y1m | 11 | 无 | 6 | 12 | 15 | 29 | 59 | 无 | 出院 |
| 2 | 塑性支气管炎,高碳酸血症,高乳酸血症,白细胞减少症 | 4y1m | 14.5 | 无 | 96 | 7 | 12 | 25 | 39 | 无 | 出院 |
| 3 | ARDS,血二系减少 | 1y6m | 9.7 | 无 | 25 | 9 | 12 | 28 | 28 | 无 | 转院康复 |
| 4 | ARDS,气漏综合征,急性肝损,胰腺炎 | 5y | 16.5 | 无 | 24 | 8 | 15 | 38 | 76 | 腹腔出血 | 出院 |
| 5 | ARDS, 中毒性脑病,血三系减少症 | 1y9m | 11.5 | 支原体,甲流 | 22 | 9 | 13 | 23 | 31 | 无 | 出院 |
| 6 | ARDS,高碳酸血症,中毒性脑病,血三系减少症 | 2y7m | 11 | 支原体 | 42 | 10 | 12 | 17 | 29 | 肺出血 | 死亡 |
| 7 | 急性肾衰,急性肝损 | 4y6m | 13.3 | 支原体 | 5 | 86 | 86 | 86 | 86 | 胃肠道出血、右足趾坏疽 | ECMO转院后肺移植术后死亡 |
| 8 | 脓毒性休克,高碳酸血症,中毒性脑病,急性肾衰,急性肝损 | 2y10m | 12.5 | 无 | 30 | 9 | 26 | 49 | 56 | 血胸 | 转院康复 |
| 9 | 气管狭窄,气漏综合征,高碳酸血症,高乳酸血症 | 6m | 6.2 | 铜绿假单胞菌 | 120 | 36 | 39 | 44 | 45 | 气胸、脑梗 | 死亡 |
| 注:MV:机械通气;ICU:重症监护室; ARDS:急性呼吸窘迫综合征。 | |||||||||||
| 病例 | 呼吸机模式 | OI | PO2/FiO2 | FiO2(%) | MAP(cmH2O) | PIP/ΔP(cmH2O) | Rate/F(次/min) | Peep | pH | PO2(mmHg) | PCO2(mmHg) | SaO2(%) | |||||||||||||||||||||||
| 前 | 后 | 前 | 后 | 前 | 后 | 前 | 后 | 前 | 后 | 前 | 后 | 前 | 后 | 前 | 后 | 前 | 后 | 前 | 后 | 前 | 后 | 前 | 后 | ||||||||||||
| 1 | APRV | SIMV | 48 | 3 | 43 | 310 | 100 | 50 | 21 | 10 | 31 | 16 | 40 | 15 | 7 | 7 | 7.383 | 7.350 | 43.0 | 155 | 41.8 | 54.1 | 65 | 99 | |||||||||||
| 2 | SIMV | SIMV | 30 | 4 | 47 | 275 | 100 | 40 | 14 | 10 | 30 | 21 | 40 | 20 | 3 | 6 | 7.256 | 7.379 | 46.9 | 110 | 66.8 | 40.2 | 76.1 | 99 | |||||||||||
| 3 | APRV | SIMV | 74 | 12 | 34 | 97 | 100 | 70 | 25 | 12 | 34 | 28 | 40 | 20 | 2 | 10 | 7.498 | 7.500 | 33.9 | 68 | 50.6 | 32.6 | 64.0 | 99 | |||||||||||
| 4 | HFO→SIMV | SIMV | 29 | 3 | 49 | 260 | 98 | 50 | 14 | 9 | 23 | 13 | 60 | 20 | 8 | 6 | 7.471 | 7.488 | 48.0 | 130 | 47.1 | 42.3 | 86.2 | 98.9 | |||||||||||
| 5 | SIMV | SIMV | 34 | 13 | 58 | 83 | 100 | 70 | 20 | 11 | 31 | 21 | 50 | 20 | 13 | 10 | 7.473 | 7.419 | 58.2 | 58 | 41.2 | 44.6 | 80.0 | 90 | |||||||||||
| 6 | HFO | SIMV | 30 | 6 | 43 | 164 | 99 | 70 | 13 | 11 | ΔP=24 | 16 | 5Hz | 20 | 8 | 7 | 7.226 | 7.520 | 43.3 | 98.6 | 83.6 | 34.3 | 71.0 | 100 | |||||||||||
| 7 | APRV | SIMV | 44 | 5 | 44 | 172 | 100 | 50 | 19 | 9 | 29 | 14 | 37 | 20 | 7 | 6 | 7.332 | 7.344 | 43.5 | 86 | 44.4 | 38.9 | 69.5 | 97 | |||||||||||
| 8 | HFO | SIMV | 29 | 2 | 71 | 442 | 100 | 40 | 21 | 10 | ΔP=40 | 18 | 6Hz | 15 | 9 | 9 | 7.204 | 7.276 | 71.3 | 177 | 61.3 | 42.1 | 94.0 | 99.2 | |||||||||||
| 9 | HFO→SIMV | BIPAP | 43 | 3 | 30 | 340 | 100 | 60 | 13 | 9 | 31 | 26 | 40 | 20 | 4 | 4 | 7.299 | 7.559 | 30.0 | 204 | 75.4 | 25.7 | 50.0 | 99 | |||||||||||
| 注:OI:氧合指数;MAP:平均气道压;PIP:吸气末峰压;PEEP:呼气末正压。PIP和PEEP是呼吸机SIMV(同步间歇指令通气)和APRV(气道压力释放通气)模式气道压力参数,振幅(△P)和频率(F)是呼吸机HFO(高频震荡通气)模式参数;1 mmHg=0.133 kPa;1 cmH2O=0.098 kPa | |||||||||||||||||||||||||||||||||||
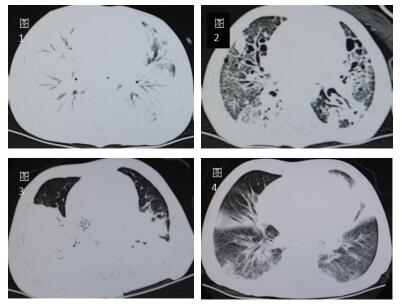
初期表现为单侧节段性实变为主(3/9),双侧散在片状影或大片融合灶(6/9),伴有部分肺气肿。快速进展至双侧大片肺实变(5/9))或者“白肺”(4/9),伴胸腔积液或者气胸、纵隔气肿。恢复期多见背段、双下肺散在片状影残留(7/9),部分发展为肺纤维化及肺坏死灶(2/9)。典型影像学改变见下图。
|
| 图 1 图 1、2分别示例7急性期,两肺几乎完全实变;恢复期,肺纤维化及坏死空洞图。图 3、4分别示例4急性期,背段大面积融合实变伴肺气肿;恢复期,树芽状增生,毛玻璃样变。 |
|
|
采取右侧颈内静脉-右侧颈总动脉模式行静脉-动脉ECMO治疗(VA-ECMO),插管成功后连接ECMO系统(米道斯2400膜肺,德国;索林儿童型膜肺,意大利)。转速2 000~3 000 r/min左右,吸入氧体积分数(FiO2):80~100%。ECMO辅助流量60~100 mL/(min·kg),维持静脉血氧饱和度65%以上,FiO2:0.4~1.0,维持动脉氧饱和度不低于0.95。
1.4 ECMO抗凝管理肝素持续泵注抗凝,维持ACT在160~200 s之间,APTT延长至正常值的1.5~2.5倍,保持纤维蛋白原 > 1.0 g/L,血小板计数 > 50×109/L。值得注意的是长时间的ECMO支持、患者本身的造血与凝血功能低下以及各类有创操作都可能导致出血并发症的发生。本组病例中共有4例出血并发症,原因分别是:例4因股静脉置管致腹腔出血;例6因感染致骨髓抑制,严重血小板低下致肺出血不可控;例7病程持续2月,ECMO套包长时间应用下凝血物质消耗增快致胃肠道出血;例8因胸水穿刺导致血胸。
2 结果9例重症腺病毒肺炎患儿年龄小,体质量低,均有不同程度的营养不良,例7存在重度营养不良。ECMO治疗时间为9.0 d(8.5 d, 24 d),呼吸机支持时间15 d(12 d,33 d),平均ICU时间29 d(24 d,46.5 d),平均住院时间45 d(30 d,67.5 d)。共有7例存活出院,出院存活率为77.8%,长期存活率为66.7%,其中例3、例8仍需要鼻导管吸氧,转康复医院治疗。死亡3例,2例ECMO支持超过30 d均死亡。3例死亡原因分别为:例6因感染致骨髓抑制,三系血细胞减少,严重血小板低下致肺出血不可控放弃治疗;例7ECMO支持2月余,因肺纤维化不可逆,转院后行肺移植手术,术后未长期存活;例9因气道狭窄术后双肺实变无好转放弃治疗。合并其他病原体感染共4例(见表 1),但从死亡原因分析,合并感染并非是死亡直接原因。ECMO期间机械并发症4例,表现为ECMO系统血栓或者管道血栓形成,更换膜肺。存活的6例患儿随访3至6个月,恢复期头颅MRI或CT检查显示均正常。例3、例8转院康复1个月后好转,脱离鼻导管吸氧;例1、例2、例4、例5均在大气下活动耐力良好,能自如行走、玩耍。随访3个月,例8左肺实变、坏死、萎缩,余病例实变大部分吸收,部分遗留少量片状影。
3 讨论本研究回顾了近2年ECMO支持的重症腺病毒肺炎病例,总结分析后观察到本组病例出院存活率为77.8%,3~6个月存活率为66.7%。重症腺病毒肺炎常表现部分渗出融合与间质气肿等同时存在,可快速进展为两肺实变或ARDS,长时间可发展为肺纤维化或坏死灶,须针对不同阶段进行肺保护以及应用各种手段努力促进肺修复;肺外器官功能障碍发生率高,可致多器官功能衰竭,白细胞、甚至三系血细胞减少;支持时间长,需要注意机械并发症和出凝血相关并发症的预防,重视营养支持和其他重要脏器的保护。
重症腺病毒肺炎对肺组织造成严重的损伤,因此,ECMO期间促进肺修复是重中之重。在运行期间,采用保护性肺通气:设置呼吸机FiO2为0.40~0.60,小潮气量3~6 mL/kg,频率10~15次/min,呼气末正压(positive end expiratory pressure,PEEP)8~10 cmH2O,气道峰压小于30 cmH2O[8]。部分患者严重气漏综合征,采用高频呼吸机振荡通气。适当的镇静肌松,勤拍背吸痰清理呼吸道,因ECMO期间肝素抗凝,使用硅胶管吸痰且动作轻柔,避免气道损伤导致出血。肺实变者每天上午和下午各4~6 h俯卧位通气;肺不张者纤支镜吸痰及气道灌洗;每天肺部听诊、胸片结合呼吸机气道压力变化评估肺功能状况,必要时胸部CT检查。同时治疗原发病变;随肺顺应性增加适当增加潮气量或手动膨肺锻炼肺功能,为撤机做准备。如合并有先天性气管狭窄等气道畸形,可后在ECMO下行手术治疗。
腺病毒是病毒性肺炎的第四大死亡原因[2]。据国际生命支持组织(ELSO)报道,1992-2016年全球共有327例ECMO支持的重症腺病毒患儿,总体病死率为49%;新生儿腺病毒ECMO支持的病死率高达86.4%[9]。腺病毒毒力强、缺少有效抗病毒药物,婴幼儿或免疫功能障碍时,容易同时发生其他重要器官的损害甚至多器官功能衰竭(MODS)[10-11]。本组患儿合并有心血管功能障碍、急性肾衰竭、急性肝损伤、胰腺炎以及血细胞减少症等,合并症大大增加了治疗难度。其中,合并脓毒性休克致心功能衰竭的病例选用静脉-动脉ECMO(VA-ECMO)支持;合并有急性肾功能衰竭的病例联合CRRT治疗。单纯呼吸衰竭的ECMO患儿,理论上来讲静脉-静脉ECMO(VV-ECMO)更合适,生存率高于VA-ECMO[12]。但重症腺病毒患儿年龄偏小,体质量低,因此,在没有双腔静脉插管的条件下,考虑到回流和再循环的因素本中心选择了颈部插管VA-ECMO模式。如果评估ECMO支持将超过30 d,可结合血管B超综合评估患儿血管条件,改VA-ECMO为VV-ECMO模式。
腺病毒ECMO支持时间的长短与预后呈相关性:支持时间 < 141 h、141~235 h、235~429 h以及 > 429 h的病死率分别为: 54.2%、51.6%、49.2%和79.2%。ECMO支持超过28 d的生存率下降至38%[5, 9]。这与时间越长肺实变越不容易吸收,肺泡复张可能性越低,肺泡细胞越有可能损伤坏死有关。但也有文献报道了超过30 d的腺病毒肺炎经ECMO支持后好转的经验,值得借鉴[13]。因此,随着经验的积累,需考虑到部分腺病毒患儿或许需要长期的ECMO支持。虽然本中心2例ECMO支持时间超过30 d的均未存活,但我们总结经验后发现长时间ECMO支持的病例需要注意机械并发症和出凝血相关并发症的预防,重视营养支持和其他重要脏器的保护,以等待好转的时机或为肺移植创造条件。精准的抗凝管理,严格并常规化地系统检查,可减少机械并发症和出凝血并发症的发生。如发现膜肺或者管路血栓且伴有膜肺压差变大或伴有临床血栓栓塞表现的,需及时更换膜肺。此外,每日凝血谱及血常规检测,发现凝血物质或血小板快速消耗的,应考虑ECMO系统内微血栓形成,及时更换膜肺,以尽量减少血制品的输注造成的肺损伤以及液体超负荷。营养支持也是影响患儿预后的因素之一[14-16]。优先肠内营养,如果ECMO患儿因使用镇静镇痛及肌松剂,造成胃肠蠕动功能减弱而有胃储留的,可考虑置入空肠喂养管喂养。如果反复胃肠道出血不耐受、胃储留或腹泻的患儿,考虑静脉营养支持,保证热卡达到50~60 kcal/kg。
本研究资料还显示有2例三系血细胞减少,3例白细胞减少,危重型病例出现了骨髓抑制的表现。严重的白细胞减少(WBC < 1 500/mm3),使机体缺乏足够的淋巴细胞及粒细胞抵抗病毒和细菌,导致感染难以控制。而严重血小板减少给ECMO出凝血的管理带来极大的难度,1例患儿因反复气管出血放弃治疗而死亡。据文献报道,导致儿童重型腺病毒感染的类型,如7型,容易出现白细胞减少症(< 5 000/mm3)及血小板减少症(< 150 000/mm3),与其不良结局密切相关[17]。同时,出现二系至三系的减少,需要与噬血细胞性淋巴组织细胞增多症(HLH)相鉴别[3]。
综上所述,ECMO是传统呼吸机治疗无效重症腺病毒肺炎的有效治疗手段。ECMO让病死率高达80%以上的重症腺病毒患者有长期存活的机会,使我们有机会深入认识腺病毒致肺损伤的临床过程与转归。重症腺病毒肺炎的ECMO支持,并发症多,支持时间长,管理难度大,病死率高。因此,对这类患儿的ECMO治疗需要进一步积累经验,对符合ECMO指征的重症腺病毒患儿,及时应用ECMO支持,能提高其生存率。
利益冲突 所有作者均声明不存在利益冲突。
| [1] | Kajon A, Lynch JⅡI. Adenovirus: epidemiology, global spread of novel serotypes, and advances in treatment and prevention[J]. Semin Respir Crit Care Med, 2016, 37(4): 586-602. DOI:10.1055/s-0036-1584923 |
| [2] | Ruuskanen O, Lahti E, Jennings LC, et al. Viral pneumonia[J]. Lancet, 2011, 377(9773): 1264-1275. DOI:10.1016/s0140-6736(10)61459-6 |
| [3] | 国家卫生健康委员会, 国家中医药管理局. 儿童腺病毒肺炎诊疗规范(2019年版)[J]. 传染病信息, 2019, 32(4): 293-298. DOI:10.3969/j.issn.1007-8134.2019.04.002 |
| [4] | Fu YX, Tang ZZ, Ye ZX, et al. Human adenovirus type 7 infection causes a more severe disease than type 3[J]. BMC Infect Dis, 2019, 19: 36. DOI:10.1186/s12879-018-3651-2 |
| [5] | Prodhan P, Bhutta AT, Gossett JM, et al. Extracorporeal membrane oxygenation support among children with adenovirus infection[J]. ASAIO J, 2014, 60(1): 49-56. DOI:10.1097/mat.0000000000000013 |
| [6] | 叶莉芬, 张晨美, 范勇, 等. 体外膜肺氧合救治儿童重度急性呼吸窘迫综合征的适应证和时机[J]. 中华急诊医学杂志, 2019, 28(7): 889-892. DOI:10.3760/cma.j.issn.167l-0282.2019.07.017 |
| [7] | 张育才, 周易平, 崔云, 等. 体外膜肺氧合挽救儿童难治低氧性呼吸衰竭疗效的初步观察[J]. 中华急诊医学杂志, 2020, 29(6): 788-792. DOI:10.3760/cma.j.issn.1671-0282.2020.06.008 |
| [8] | Xie H, Zhou ZG, Jin W, et al. Ventilator management for acute respiratory distress syndrome associated with avian influenza A (H7N9) virus infection: A case series[J]. World J Emerg Med, 2018, 9(2): 118-124. DOI:10.5847/wjem.j.1920-8642.2018.02.006 |
| [9] | Ramanathan K, Tan CS, Rycus P, et al. Extracorporeal membrane oxygenation for severe adenoviral pneumonia in neonatal, pediatric, and adult patients[J]. Pediatr Crit Care Med, 2019, 20(11): 1078-1084. DOI:10.1097/pcc.0000000000002047 |
| [10] | Shachor-Meyouhas Y, Hadash A, Kra-Oz Z, et al. Adenovirus Respiratory Infection among Immunocompetent Patients in a Pediatric Intensive Care Unit During 10-year period: Co-morbidity is common[J]. Isr Med Assoc J, 2019, 21(9): 595-598. |
| [11] | Kuang ZS. Clinical characteristics and prognosis of communityacquired pneumonia in autoimmune diseaseinduced immunocompromised host: a retrospective observational study[J]. World J Emerg Med, 2020, 11(3): 145. DOI:10.5847/wjem.j.1920-8642.2020.03.003 |
| [12] | Kovler ML, Garcia AV, Beckman RM, et al. Conversion from venovenous to venoarterial extracorporeal membrane oxygenation is associated with increased mortality in children[J]. J Surg Res, 2019, 244: 389-394. DOI:10.1016/j.jss.2019.06.058 |
| [13] | Allibhai TF, Spinella PC, Meyer MT, et al. Survival after prolonged pediatric extracorporeal membrane oxygenation support for adenoviral pneumonia[J]. J Pediatr Surg, 2008, 43(8): e9-e11. DOI:10.1016/j.jpedsurg.2008.03.065 |
| [14] | Dembele BPP, Kamigaki T, Dapat C, et al. Aetiology and risks factors associated with the fatal outcomes of childhood pneumonia among hospitalised children in the Philippines from 2008 to 2016: a case series study[J]. BMJ Open, 2019, 9(3): e026895. DOI:10.1136/bmjopen-2018-026895 |
| [15] | Farr BJ, Rice-Townsend SE, Mehta NM. Nutrition Support During Pediatric Extracorporeal Membrane Oxygenation[J]. Nutr Clin Pract, 2018, 33(6): 747-753. DOI:10.1002/ncp.10212 |
| [16] | Jenks CL, Raman L, Dalton HJ. Pediatric extracorporeal membrane oxygenation[J]. Crit Care Clin, 2017, 33(4): 825-841. DOI:10.1016/j.ccc.2017.06.005 |
| [17] | Lin MR, Yang SL, Gong YN, et al. Clinical and molecular features of adenovirus type 2, 3, and 7 infections in children in an outbreak in Taiwan, 2011[J]. Clin Microbiol Infect, 2017, 23(2): 110-116. DOI:10.1016/j.cmi.2016.11.004 |
 2020, Vol. 29
2020, Vol. 29




